
(12分)某化学学习小组采用下图所提供的仪器装置(夹持仪器已略去)设计实验:验证浓硝酸的氧化性。实验表明浓硝酸能将NO氧化成NO2,由此得出的结论是浓硝酸具有氧化性。

试回答有关问题:
(1)仪器接口的连接顺序为___________ ____________;
(2)按(1)中连接顺序安装好装置后下一步的操作是___ ____;
加入药品后,打开弹簧夹,通入CO2 一段时间,通入CO2的目的是___________________________________________________;
关闭弹簧夹,将装置④中的导管末端伸入氢氧化钠溶液中是为了_________________ __________________;
(3)装置②发生反应的化学方程式是___________________________________;
(4)该小组得出的结论所依据的实验现象是_____________________________。
(1)a→c→b→d
(2)检验装置气密性;排尽装置中的空气;
吸收二氧化氮,防止其扩散到空气中污染空气
(3) 3NO2+H2O=2HNO3+NO (4)②中逸出的无色气体通过③时变成红棕色
【解析】(1)①是气体的发生装置,浓硝酸和铜反应生成NO2,NO2溶于水即生成NO,所以要检验浓硝酸的氧化性,需要把NO通入到浓硝酸中,氮的氧化物属于大气污染物,需要进行尾气处理,因此最后要通入到氢氧化钠溶液中,即顺序为a→c→b→d。
(2)装置连接好以后,必须最÷检验装置的气密性。因为空气中的氧气也能氧化NO,所以为了防止干扰,需要排尽装置中的空气。
(3)NO2溶于水的方程式为3NO2+H2O=2HNO3+NO。
(4)NO是无色,被氧化生成NO2后气体颜色变为红棕色,所以当②中逸出的无色气体通过③时变成红棕色,即说明结论是正确的。


科目:高中化学 来源: 题型:阅读理解
A、B、C、D分别代表四种不同的元素。A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍,D原子的L电子层的p轨道有3个电子。
(1)C原子的电子排布式为 ?? ,若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于 ?? ,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是 ?? 。
(2)当n=2时,B原子的结构示意图为 ?? ,B与C形成的晶体属于 晶体。当n=3时,B与C形成的晶体中,B原子的杂化方式为 ?? ,该晶体中最小的环共有 ?? 个微粒构成,微粒间的作用力是 ?? 。
(3)若A原子的最外层电子排布为4s1,B原子的价电排布为3s23p2,A在元素周期表中的位置是 ?? ,A、B、C、D四种元素的第一电离能由大到小的顺序是
?? (用元素符号表示)。
B.(实验化学,12分)某化学研究性学习小组进行了一系列“带火星的木炭复燃”的实验,实验装置如下图所示。
 (1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
(1)甲组同学探究“使带火星木炭复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下:
| 编号 | I | II | III | IV | V |
| V(O2)/mL | 60 | 40 | 20 | 12 | 10 |
| V(空气)/mL | 40 | 60 | 80 | 88 | 90 |
| 现象 | 木炭复燃 | 木炭复燃 | 木炭复燃 | 木炭有时燃烧,有时不燃烧 | 木炭 不复燃 |
回答下列问题:
①使带火星木炭复燃的O2的体积分数最小约为 ?? 。
②用带火星木炭检验集气瓶里是否集满O2,若木炭复燃,能否认为集气瓶里的气体一定是纯净的O2?答: ?? (填“能”或“否”)。
③若按照3∶2的比例混合O2和CO2气体,该混合气体能否使带火星的木炭复燃?
答: ?? (“能”、“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 | 制取气体A(下列反应产生的混合气体) | B中的现象 | 结论 |
| a | 在烧瓶中加热适量浓HNO3 4HNO3 △ 4NO2↑+O2↑+2H2O↑ | 充满红棕色气体,木炭不复燃,火星熄灭 | NO2不支持燃烧 |
| b | 加热AgNO3固体 2AgNO3 △ 2NO2↑+O2↑+2Ag | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
| c | 加热Cu(NO3)2固体 2Cu(NO3)2 △ 4NO2↑+O2↑+2CuO | 充满红棕色气体,木炭复燃 | NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?说出你的理由。
a. ?? ,原因是 ?? 。
b. ?? ,原因是 ?? 。
c. ?? ,原因是 ?? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分〉某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的KSP为,饱和亚硫酸中
。
(1)将0.1 mol• L—1的BaCl2溶液滴入饱和亚硫酸中,_______(填“能”或“不能”)生成BaSO3沉淀,原因是______________(请写出必要的推断过程)。
(2)浓硫酸的沸点为338°C,酒精灯火焰的温度为400〜5000C,甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
①写出加热试管中发生反应的化学方程式:_____________________
②白色沉淀的化学式是_______,请用离子方程式表示生成该白色沉淀的可能原因___________________________________
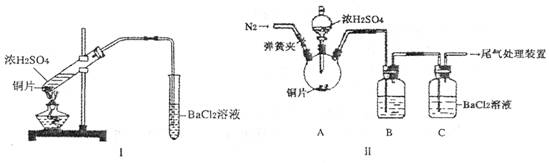
(3)乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检验)。
①打开弹簧夹,通入N2—段时间后关闭弹簧夹
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
操作①的目的是_______,洗气瓶B中的试剂是______________。
(4)丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,丙滴加的试剂可能是______________。
A. NaOH 溶液 B. Na[Al(OH)4]溶液 C. H2O2 溶液 D.酸性 KMnO4 溶液
查看答案和解析>>
科目:高中化学 来源:2012届河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:实验题
(12分〉某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的KSP为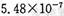 ,饱和亚硫酸中
,饱和亚硫酸中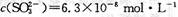 。
。
(1) 将0.1 mol ? L—1的BaCl2溶液滴入饱和亚硫酸中,_______ (填“能”或“不能”)生成BaSO3沉淀,原因是______________ (请写出必要的推断过程)。
(2) 浓硫酸的沸点为338°C,酒精灯火焰的温度为400?5000C,甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
①写出加热试管中发生反应的化学方程式:_____________________
②白色沉淀的化学式是_______,请用离子方程式表示生成该白色沉淀的可能原因___________________________________
(3) 乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检验)。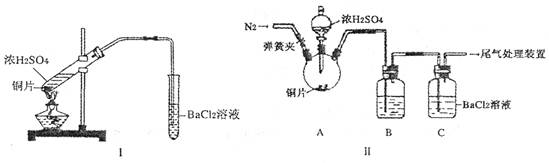
①打开弹簧夹,通入N2—段时间后关闭弹簧夹
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
操作①的目的是_______,洗气瓶B中的试剂是______________。
(4) 丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,丙滴加的试剂可能是______________。
| A.NaOH溶液 | B.Na[Al(OH)4]溶液 | C.H2O2溶液 | D.酸性 KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河南省郑州市高三第一次质量预测化学试卷(解析版) 题型:实验题
(12分〉某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀。查阅资料得知常温下BaSO3的KSP为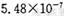 ,饱和亚硫酸中
,饱和亚硫酸中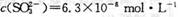 。
。
(1) 将0.1 mol • L—1的BaCl2溶液滴入饱和亚硫酸中,_______ (填“能”或“不能”)生成BaSO3沉淀,原因是______________ (请写出必要的推断过程)。
(2) 浓硫酸的沸点为338°C,酒精灯火焰的温度为400〜5000C,甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸。
①写出加热试管中发生反应的化学方程式:_____________________
②白色沉淀的化学式是_______,请用离子方程式表示生成该白色沉淀的可能原因___________________________________
(3) 乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检验)。
①打开弹簧夹,通入N2—段时间后关闭弹簧夹
②滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。
操作①的目的是_______,洗气瓶B中的试剂是______________。
(4) 丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,也产生不溶于盐酸的白色沉淀,丙滴加的试剂可能是______________。
A. NaOH 溶液 B. Na[Al(OH)4]溶液 C. H2O2 溶液 D.酸性 KMnO4 溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
(每空2分,共12分)某化学研究性学习小组探讨Fe3+和SO32―之间发生怎样的反应,请你一起参与并协助他们完成实验。
⑴提出猜想:
甲同学认为发生氧化还原反应,其反应的离子方程式为 ;
乙同学认为发生双水解反应,其反应方程式为2Fe3++3SO32―+6H2O=2Fe(OH)3(胶体)+3H2SO3;
⑵实验验证:
丙同学设计了下列实验来探究反应的可能性。
①为了检验所用Na2SO3是否变质,应选用的试剂是 。
②取5mLFeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成)。
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色。
⑶得出结论:
①根据丙同学的实验得出的结论是: ;
②实验③中溶液变成血红色的离子方程式为 。
⑷拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是 。
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-小外,还有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com