
可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是
A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-==4OH-
B.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-==Al(OH)3↓
C.以NaOH溶液为电解液时,电 池在工作过程中电解液的pH保持不变
池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源:2017届江苏省高三12月月考化学试卷(解析版) 题型:选择题
下列物质转化在给定条件下能实现的是
A.FeS2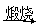 SO3
SO3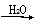 H2SO4
H2SO4
B.NaCl(aq) Na
Na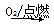 Na2O2
Na2O2
C.Fe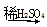 FeSO4(aq)
FeSO4(aq)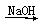 Fe(OH)2
Fe(OH)2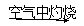 Fe2O
Fe2O 3
3
D.Fe2O3 FeCl3(aq)
FeCl3(aq) 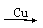 Fe
Fe
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学卷(解析版) 题型:填空题
在铁和氧化铁的混合物 15 g 中加入150 mL 稀 H2SO4 放出氢气 1.68 L(标准状况下)。当反应停止后,铁与氧化铁均无剩余,且溶液中没有 Fe 3+存在。为了中和过量 H2SO4,并使 Fe 2+ 完全转化为 Fe(OH) 2沉淀,共耗用 3 mol·L-1 NaOH 溶液 200 mL。
(1) 写出溶液中反应的化学方程式:___________________;__________________;_________________。
(2) 混合物中铁的质量为______________,氧化铁的质量为______________。
(3) 稀 H 2 SO 4的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学卷(解析版) 题型:选择题
有 9.7gCu 和 Zn 的合金与足量的稀 HNO3反应, 还原产物只有 NO 气体, 其体积在标准状况下为 22.4L。 将溶液稀释为 1L, 测得溶液的 C(H+)=0.1 mol/L, 此时溶液中 NO3-的浓度为( )
A.0.3mol/L B.0.4mol/L C.0.5mol/L D. 0.6mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上大考二化学卷(解析版) 题型:填空题
(1)测得一定温度下某溶液的pH=6.5,且溶液中氢离子与氢氧根离子物质的量相等,
此溶液呈 性。测定温度 25℃(填“高于”、“低于”或“等于”)。
(2)将25℃下pH=12的NaOH溶液a L与pH=1的HCl溶液b L混合。若所得混合液为中性,则a:b= 。
(3)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合,溶液呈 (填“酸性”、“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“>”、“<”或“=”)。
(4)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+) c(CH3COO-)(填“>”、“<”或“=”,下同)。
(5)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+I-(aq)+H+(aq) I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3
总反应的化学方程式为_______________________,其反应△H=_________。
(6)已知:CH3COOH CH3COO-+H+ Ka
CH3COO-+H+ Ka
H2O H++OH- Kw
H++OH- Kw
则CH3COO-+H2O CH3COOH+OH-平衡常数K=___________________。
CH3COOH+OH-平衡常数K=___________________。
(7)常温下,如果要使c(Fe3+)<10-5mol/L,则应控制溶液pH的范围为________。
已知:Ksp[Fe(OH)3] = 8.0×10-38;lg5 = 0.7
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上大考二化学卷(解析版) 题型:选择题
在饱和Mg(OH)2溶液中,c(OH-)=1.0×10-4 mo l·L-1。若往该溶液中加入NaOH溶液,使溶液的c(OH-)变为原来的10倍,则Mg(OH)2的溶解度在理论上将
l·L-1。若往该溶液中加入NaOH溶液,使溶液的c(OH-)变为原来的10倍,则Mg(OH)2的溶解度在理论上将
A.变为原来的10-3倍 B.变为原来的10-2倍
C.变为原来的10倍 D.不发生变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二12月检测化学试卷(解析版) 题型:填空题
碳元素的单质及其化合物与人类的生产、生活、科研息息相关。请回答下列问题:
(1) 绿色植物的光 合作用吸收CO2释放O2的过程可以描述为以下两步:
合作用吸收CO2释放O2的过程可以描述为以下两步:
2CO2(g)+2H2O(l)+2C5H10O4(s) = 4(C3H6O3)+ (s)+O2(g)+4e- △H=+1360 kJ·mol-1
(s)+O2(g)+4e- △H=+1360 kJ·mol-1
12(C3H6O3)+(s)+12e- = C6H12O6(s,葡萄糖)+6C5H10O4(s)+3O2(g) △H=-1200 kJ·mol-1
则绿色植物利用二氧化碳和水合成葡萄糖并放出氧气的热化学方程式 为: ,
为: ,
(2) 工业上利用水煤气合成甲醇的主要反应可表示为:
H2(g)+1/2CO(g)
 1/2CH3OH(g) △H=-45.4kJ·mol-1。
1/2CH3OH(g) △H=-45.4kJ·mol-1。
向容积为1L的密闭容器中加入0.10 mol H2和0.05mol CO,在一定温度下发生 上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①该温度条件下,上述反应的化学平衡常数K= 。
②若容器容积不变,下列措施可增加CH3OH产率的是 (填写序号)。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入O.10 mol H2和0.05mol CO
③若该反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,则平衡向 (填“逆向”、“正向”或“不”)移动,化学平衡常数K (填“增大”、“减小”或“不变”)。
(3) 已知反应:2CO(g)+O2(g) = 2CO2(g) △H<0,根据原电池原理该反应能否设计成燃料电池。若能,请写出当电解质溶液为KOH溶液时的负极反应式(若不能,该空可不作答): 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二12月检测化学试卷(解析版) 题型:选择题
下列溶液中一定呈中性的是
A.pH=7的溶液
B.c(H+)=c(OH-)=10-6mol·L-1的溶液
C.能够与Na反应生成H2的溶液
D.电解食盐水最后所得溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北宜昌金东方中学、三峡高中高一11月月考化学卷(解析版) 题型:选择题
下列说法中正确的是
A.1 L水中溶解了58.5 gNaCl,该溶液的物质的量浓度为1 mol·L-1
B.将22.4LNH3溶于水配 成1L溶液,则所得溶液的浓度为1 mol·L-1
成1L溶液,则所得溶液的浓度为1 mol·L-1
C.将7.8gNa2O2溶于水,充分反应后稀释至200mL,则所得溶液的浓度为1 mol·L-1
D.中和100 mL 1 mol·L-1的H2SO4溶液,需NaOH固体4.0g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com