
【题目】常温下,对于①0.1mol·L-1CH3COONa溶液,②pH = 13的NaOH溶液,③pH = 1的HC1溶液,④0.1mol·L-1CH3COOH溶液,[已知Ka(CH3COOH)=1.75×10-5]下列说法正确的是
A.水电离出的c(OH-):①>②>④>③
B.①和③混合后溶液呈中性:c(Na+)+c(H+)>c(CH3COO-)+c(Cl-)
C.①和④混合后溶液呈酸性:![]() =1
=1
D.③和④分别稀释100倍后的pH:④<③
科目:高中化学 来源: 题型:
【题目】在强酸性或强碱性溶液中都不能大量共存的一组离子是( )
A.Ba2+、Fe2+、Br一、NO3— B.Na+、Ca2+、HCO3—、NO3—
C.A13+、NH4+、SO42—、Na+ D.Na+、K+、NO3—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是2H2(g)+O2(g)==2H2O(l) 请回答下列问题:
①该反应的生成物能量总和___________(填“大于”、 “小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量____________(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点______________________。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________。
(3)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。反应时释放大量热并快速产生大量气体。已知在101kPa,298K时,1mol液态N2H4在氧气中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是__________ 。又知:H2O(g )=H2O (l)△H=-44 kJ·mol-1,若1mol液态N2H4在氧气中完全燃烧生成N2和液态水,则放出热量为______________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子的检验,正确的是( )
A.某化合物焰色反应呈黄色,说明该物质中一定含有Na+
B.向某溶液中加入盐酸有气泡产生,说明一定有![]()
C.向某溶液中加入氯化钡溶液,有白色沉淀产生,说明一定有![]()
D.向某溶液中加入硝酸银溶液,有白色沉淀产生,说明一定有Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】升高温度时,化学反应速率加快,主要原因是
A. 分子运动速率加快,使该反应物分子的碰撞机会增多
B. 反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多
C. 该化学反应的过程是吸热的
D. 该化学反应的过程是放热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:烧杯、铁架台(带铁圈)、三角架、分液漏斗、酒精灯、玻璃棒、蒸发皿和蒸馏烧瓶,从缺少仪器的角度分析,不能进行的实验项目是( )
A. 过滤 B. 蒸发 C. 分液 D. 萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g) +CO(g)![]() COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。下列说法不正确的是
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。下列说法不正确的是
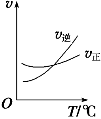
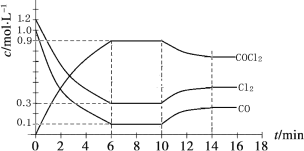
A.0~6 min内,反应的平均速率v(Cl2)=0.15 mol ·L-1·min -1;
B.若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动;
C. 随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8) >T(15)。
D.若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用键能的大小来解释的是( )
A. N元素的电负性较大,但N2的化学性质很稳定 B. 卤族元素氢化物的稳定性逐渐减弱
C. 稀有气体一般难发生反应 D. O元素的电负性大于Cl,但Cl2比O2活泼性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com