
在指定的条件下,下列各组离子一定能大量共存的是
A.无色的溶液中:Fe3+、K+、NO3-、Cl-
B.pH=13的溶液中:NH4+、Na+、SO42-、Cl-
C.含有大量Ba2+ 的溶液中:NH4+、Na+、Cl-、H+
D.c(H+)=0.1 mol·L-1的溶液中:K+、I-、Cl-、NO3-
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源:2015届浙江省宁波市八校高二上学期期末联考化学试卷(解析版) 题型:选择题
有关溶液中的反应3KSCN+FeCl3 Fe(SCN)3+3KCl的研究,下列说法不正确的是
Fe(SCN)3+3KCl的研究,下列说法不正确的是
A.向平衡体系中加入少量KCl固体,溶液红色变浅
B.加入少量FeCl3固体,溶液红色加深
C.给体系加压,溶液红色没有明显变化
D.Fe(SCN)3属于盐类,是一种弱电解质
查看答案和解析>>
科目:高中化学 来源:2015届河南许昌市五校高二下学期第一次联考化学试卷(解析版) 题型:选择题
下列关于有机物的结构及性质说法错误的是( )
A.2-丁烯是石油裂解的产物之一,它存在顺反异构
B.乙酸、苯酚、乙醇都可以与金属钠反应产生氢气,所以它们都是电解质
C.该有机物 中,最多有19个碳原子共面
中,最多有19个碳原子共面
D.甲苯的硝化反应能说明侧链对苯环的影响
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高二上学期期末检测化学试卷(A)(解析版) 题型:填空题
(10分)工业上制备BaCl2的工艺流程图如图:
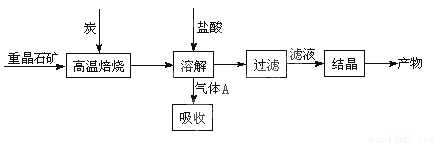
某研究小组在实验室用重晶石(主要成分BaSO4)对工业过程进行模拟实验。查资
料得:
BaSO4(s) + 4C(s) 4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
4CO(g) + BaS(s) ΔH1 = +571.2 kJ·mol-1 ①
BaSO4(s) + 2C(s) 2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
2CO2(g) + BaS(s) ΔH2= +226.2 kJ·mol-1 ②
(1)①制备BaCl2的工艺流程图中气体A用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为 。
②常温下,相同浓度的Na2S和NaHS溶液中,下列说法正确的是 (填字母)。
A.Na2S溶液的pH比NaHS溶液pH小
B.两溶液中含有的离子种类不同
C.两溶液中滴入同体积同浓度的盐酸,产生气体速率相等
D.两溶液中加入NaOH固体,c(S2-)都增大
E.NaHS溶液中:c(Na+) >c(HS-) >c(OH-) >c (H+)
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,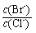 = 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
= 。 【已知:Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10】
(3)反应C(s) + CO2(g) 2CO(g)的ΔH =
2CO(g)的ΔH =
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是: (只要求答一条)。
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高二上学期期末检测化学试卷(A)(解析版) 题型:选择题
由化学能转化的热能或电能仍然是人类使用的主要能源。根据下图所示的装置,判断下列说法不正确的是
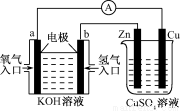
A.该装置中Cu极为阳极
B.当铜片的质量变化了12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
C.该装置中b极的电极反应式是:H2+2OH--2e- = 2H2O
D.该装置中a极为正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源:2015届河南省洛阳市高二上学期期末检测化学试卷(A)(解析版) 题型:选择题
下列有关沉淀溶解平衡的说法正确的是
A.Ksp(AB2)小于Ksp(CD),则AB2的溶解度小于CD的溶解度
B.在氯化银的沉淀溶解平衡体系中,加入蒸馏水,氯化银的Ksp增大
C.在氯化银沉淀溶解平衡体系中,加入碘化钠固体,氯化银沉淀可转化为碘化银沉淀
D.在碳酸钙的沉淀溶解平衡体系中,加入稀盐酸,溶解平衡不移动
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:填空题
氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
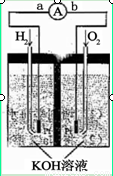
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2  2LiH
2LiH
Ⅱ.LiH+H2O=LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②由LiH与H2O作用,放出的224L(标准状况)H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高二上学期期末考试化学试卷(解析版) 题型:选择题
实验报告中,以下数据合理的是
A.用碱式滴定管量取25.03mLH2SO4溶液
B.用50mL量筒量取21.48mL稀硫酸
C.用托盘天平称取11.7gNaCl
D.用pH试纸测定HNO3溶液的pH=3.7
查看答案和解析>>
科目:高中化学 来源:2015届江西赣州市高二上学期期末联考化学试卷(解析版) 题型:选择题
Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-=Li2S+Fe。有关该电池的下列叙述中,正确的是( )
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为2Li+FeS=Li2S+Fe
C.负极的电极反应式为Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-=2Li++FeS
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com