
【题目】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。常见水处理剂还有高铁酸盐及ClO2,请回答下列问题:
(1)FeCl3可以用来刻蚀铜箔制造电路板,写出对应离子方程式 高铁酸盐是一种绿色净水剂,其有效成分是高铁酸根FeO42-。能消毒,且能净水。工业上常在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠,该反应的化学方程式为 。
(2)ClO2是一种高效、低毒的消毒剂,工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(3)漂白粉在工业中常用氯气通入石灰乳来制备,写出对应化学方程式 。在使用时将漂白粉溶于水配成溶液,放置一段时间即可使用,写出漂白粉工作原理的离子方程式 。氯水也具有漂白性,但是久置氯水因为发生了 反应而失去漂白性。
(4)描述实验室制备氢氧化铁胶体的方法 ,写出对应离子方程式 。
(5)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3
ClO3- + Fe2+ + ( ) = Fe3+ + Cl-+ ( )
【答案】(1)2Fe3+ +Cu=2Fe2+ +Cu2+;2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-;
(2)2:1;
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(4)加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热;FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(5)1;6;6H+;6;1;3H2O。
【解析】
试题分析:(1)FeCl3可以用来刻蚀铜箔制造电路板,反应的离子方程式为2Fe3+ +Cu=2Fe2+ +Cu2+;在碱性条件下,利用NaClO氧化硝酸铁,制得Na2FeO4,该反应的离子反应方程式为2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-,故答案为:2Fe3+ +Cu=2Fe2+ +Cu2+;2Fe3++3ClO-+10OH-=2FeO42-+5H2O+3Cl-;
(2)KClO3在H2SO4存在下与Na2SO3反应制得ClO2,可知SO32-被氧化成SO42-,由电子、电荷守恒可知该离子反应为2ClO3-+SO32-+2H+═2ClO2+SO42-+H2O,氧化剂为KClO3,还原剂为Na2SO3,由离子反应可知该反应氧化剂与还原剂物质的量之比为2:1,故答案为:2:1;
(3)石灰乳和氯气反应制备漂白粉,该反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;漂白粉生效的原理方程式为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;漂白粉溶液放置时间太久,又会失效,原因是2HClO![]() 2HCl+O2↑,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO
2HCl+O2↑,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;2HClO![]() 2HCl+O2↑;
2HCl+O2↑;
(4)实验室制备氢氧化铁胶体的方法是:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热,要注意实验过程不能用玻璃棒搅拌,否则溶液出现浑浊;当反应体系呈现红褐色,即制得氢氧化铁胶体,应立即停止加热,否则也容易出现浑浊,产生红褐色的氢氧化铁沉淀,往沸水中滴加饱和氯化铁溶液后,可稍微加热煮沸,但不宜长时间加热,反应原理为:FeCl3+3 H2O ![]() Fe(OH)3(胶体)+3HCl,故答案为:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热;FeCl3+3H2O
Fe(OH)3(胶体)+3HCl,故答案为:加热烧杯中的水至沸腾,向沸水滴加几滴饱和氯化铁溶液,继续煮沸至溶液呈红褐色,即停止加热;FeCl3+3H2O ![]() Fe(OH)3(胶体)+3HCl;
Fe(OH)3(胶体)+3HCl;
(5)氯酸钠氧化酸性的氯化亚铁,则反应物中有氢离子参加,则生成物中有水生成,Cl元素的化合价从+5价降低到-1价,得到6个电子,而Fe元素的化合价从+2价升高到+3价,失去1个电子,根据得失电子守恒,则氯酸根离子的系数为1,Fe2+的系数为6,则铁离子的系数也是6,氯离子的系数是1,根据电荷守恒,则氢离子的系数是6,水的系数是3,配平后离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O,故答案为:1;6;6H+;6;1;3H2O。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式为:![]() 。
。
①下列对尼泊金酯的判断错误的是 。
a.能发生水解反应
b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上
d.能与浓溴水反应产生白色沉淀。
②尼泊金酯与足量NaOH溶液在一定条件下反应的化学方程式是 。
(2)C8H8O3的另一种同分异构体甲的结构简式为:![]() 。
。
①甲中含氧官能团的名称为:羧基和 。
②甲在一定条件下跟足量的Na反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)、室温下,将1.000mol/L盐酸滴入20.00mL 1.000 mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。

(1)a点由水电离出的c(H+)=__________。
(2)d点溶液温度最高的原因是__________ 。
(II)电离常数是衡量弱电解质电离程度强弱的物理量。已知:化学式电离常数(25℃)HCN K=4.9×10-10,CH3COOH K=1.8×10-5,H2CO3 K1=4.3×10-7、K2=5.6×10-11,一氯乙酸K=1.4×10—3
(3)25℃时,有等浓度的:①NaCN溶液,②Na2CO3溶液,③CH3COONa溶液,三溶液的pH由大到小的顺序为________________________。(填序号)
(4)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_________________。
(5)下图中可以描述乙酸(甲曲线)和一氯乙酸(乙曲线)在水中的电离度与浓度关系的是( )
A.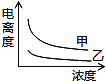 B.
B. C.
C. D.
D.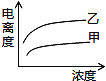
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HF、H2O、CH4、SiH4四种气态氢化物按稳定性由弱到强排列正确的是( )
A. CH4<H2O<HF<SiH4
B. SiH4<HF<CH4<H2O
C. SiH4<CH4<H2O<HF
D. H2O<CH4<HF<SiH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,用惰性电极在U型管中电解下列物质的水溶液,消耗相同的电量时生成气体的体积最大的是(不考虑气体的溶解)
A.HCl溶液 B.CuCl2溶液 C.CuSO4溶液 D.NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物。
(1)基态硒原子的价层电子排布式为 。
(2)锗、砷、硒的第一电离能大小排序为 。
(3)H2SeO3的中心原子杂化类型是 ;SeO32的立体构型是 。与SeO42互为等电体的分子有(写一种物质的化学式即可) 。
(4)H2Se属于 (填:极性或非极性)分子;单质硒的熔点为217℃,它属于 晶体。
(5)硒化锌是一种重要的半导体材料,其晶胞结构如图所示,若该晶胞密度为ρgcm3,硒化锌的摩尔质量为M g/mol。NA代表阿伏加德罗常数,则晶胞参数a为 pm。
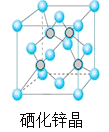
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)光束通过Fe(OH)3胶体,可看到光亮的通路,这种现象叫________;
(2)19g某二价金属的氯化物ACl2中含有0.4mol Cl-离子,求ACl2的摩尔质量________
(3)在标准状况下,测得4.2g气体A的体积是3360mL,则A可能是什么气体________
(4)在标准状况下15 g CO与CO2的混合气体,体积为11.2 L。则:CO2和CO的体积之比是________。
(5)在标准状况下,将224 L HCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。所得盐酸物质的量浓度分别是________
(6)现有以下物质:①NaCl晶体 ②盐酸 ③CaCO3固体 ④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧浓H2SO4 ⑨KOH固体;以上物质中属于电解质的是________
(7)Ca(HCO3)2溶液与少量氢氧化钠溶液混合的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y 各0.16 mol充入10 L 恒容密闭容器中,发生反应
X(g)+ Y(g)![]() 2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是( )
2Z(g) △H < 0,一段时间后达到平衡。反应过程中测定的数据如下表。下列说法正确的是( )
t / min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10-5 mol/(L·min)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠可作为氧气的来源。常温常压下二氧化碳和过氧化钠反应后,若固体质量增加了28g,反应中有关物质的物理量正确的是(NA表示阿伏加德罗常数)( )
选项 | 二氧化碳 | 碳酸钠 | 转移的电子 |
A | 1mol | 2NA | |
B | 22.4L | 1mol | |
C | 106g | 1mol | |
D | 106g | 2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com