
 =
= +2I-��������ʵ��ܶȻ��������±���
+2I-��������ʵ��ܶȻ��������±���| ���� | Cu��OH��2 | Fe��OH��3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
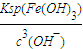 ����������Ũ�ȣ�
����������Ũ�ȣ�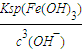 =
=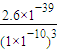 =2.6×10-9mol/L��
=2.6×10-9mol/L�� Cu��OH��2?CuCl2+2HCl+2H2O����õ���ˮCuCl2�ĺ��������ǣ���CuCl2?2H2O�����ڸ����HCl�����м�����ˮ��
Cu��OH��2?CuCl2+2HCl+2H2O����õ���ˮCuCl2�ĺ��������ǣ���CuCl2?2H2O�����ڸ����HCl�����м�����ˮ��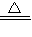 Cu��OH��2?CuCl2+2HCl+2H2O���ڸ����HCl�����м�����ˮ��
Cu��OH��2?CuCl2+2HCl+2H2O���ڸ����HCl�����м�����ˮ��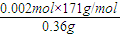 ×100%=95%��
×100%=95%��

 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д� ������ʱ����ҵ����ϵ�д�
������ʱ����ҵ����ϵ�д� ��ĩ���ƾ�ϵ�д�
��ĩ���ƾ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� | ʳ�Ρ�����ء������ |
| �⺬�� | 25��15mg/kg |
| ���淽�� | �ܷ⡢�ܹ⡢���� |
| ʳ�÷��� | ���ʱ����ʳƷ��������� |
2- 3 |
2- 6 |
| 4.2��102 |
| w |
| 4.2��102 |
| w |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 Ba2+��aq��+SO42-��aq��
Ba2+��aq��+SO42-��aq�� Ba2+��aq��+SO42-��aq��
Ba2+��aq��+SO42-��aq���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2��4��3��2��2��6 | B��0��2��1��0��1��2 | C��2��0��1��2��0��2 | D��2��8��5��2��4��10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
]��֪��I2��2![]() ��
��![]() ��2I����������ʵ��ܶȻ��������±���
��2I����������ʵ��ܶȻ��������±���
| ���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2��10��20 | 2.6��10��39 | 1.7��10��7 | 1.3��10��12 |
��1��ij����CuCl2��Һ�к���������FeCl3��Ϊ�õ�������CuCl2•2H2O���壬����________������pH��4��ʹ��Һ�е�Fe3��ת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3��)��_____________��
���˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl2•2H2O���塣
��2���ڿ�����ֱ�Ӽ���CuCl2•2H2O����ò���������ˮCuCl2��ԭ����___________________���û�ѧ����ʽ��ʾ������CuCl2•2H2O����õ�������ˮCuCl2�ĺ���������___________��
��3��ijѧϰС���á���ӵ��������ⶨ����CuCl2•2H2O�������������������I�D������Ӧ�������������ʣ��Ĵ��ȣ��������£�ȡ0.36 g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol/L Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00 mL��
�ٿ�ѡ��___________���ζ�ָʾ�����ζ��յ��������_________________��
��CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ______________________________��
�۸�������CuCl2•2H2O�������ٷ���Ϊ___________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com