
| A.Ba2+ | B.K+ | C.I- | D.SO42- |
科目:高中化学 来源:不详 题型:单选题
| A.焰色反应实验后,用稀硫酸洗净铂丝,灼烧至无色,以除去残留在铂丝上的试剂 |
| B.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,则该溶液一定含有Ag+ |
| C.欲除去氯气中少量氯化氢气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| D.托盘天平称取58.50g食盐,加1升水配制成溶液,NaCl溶液浓度为1mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向少许待测液中滴加KSCN溶液无明显变化,再滴入氯水,溶液呈红色,则待测液中含有Fe2+ |
| B.向少许待测液中滴几滴稀硝酸,再滴加少许硝酸银,有白色沉淀生成,则待测液中含有Cl- |
| C.向少许待测液中逐滴加入稀氨水至过量,产生白色胶状沉淀,后又逐渐溶解,则待测液中含有Al3+ |
| D.用洁净的铂丝用盐酸清洗后在酒精灯外焰上灼烧至无色时蘸取待测液在外焰上灼烧,透过蓝色钴玻璃观察火焰为紫色,则待测液中含有K+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.一定含有SO42- |
| B.一定含有Ag+ |
| C.一定同时含有Ag+和SO42- |
| D.含有Ag+和SO42-中的一种或二种 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 试样 | 所加试剂 | 实验现象 |
| 第一份试液 | 滴加适量的淀粉KI溶液 | 呈蓝色 |
| 第二份试液 | 滴加用盐酸酸化的BaCl2溶液 | 有白色沉淀 |
| 第三份试液 | 滴加NaOH溶液,加热,加入的NaOH溶液体积(V)与生成的沉淀、产生的气体(n)的关系如图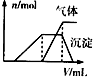 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.某溶液中加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有SO42- |
| B.用托盘天平称取5.85gNaCl固体,配制100mL、1.0mol/L的NaCl溶液 |
| C.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片 |
| D.用二硫化碳清洗残留在试管壁上少量的硫粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.FeCl3溶液中滴入KSCN溶液,溶液呈蓝色 |
| B.新制Cu(OH)2悬浊液中加入葡萄糖溶液并加热,产生砖红色沉淀 |
| C.NaOH溶液中滴入酚酞试液,溶液呈无色 |
| D.品红溶液中通入SO2气体,溶液呈紫色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.滤液C中有Fe3+ | B.A一定为FeBr2 |
| C.D溶液中存在Fe(SCN)3 | D.B为AgBr |
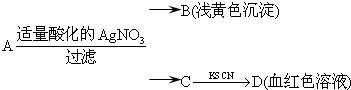
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com