
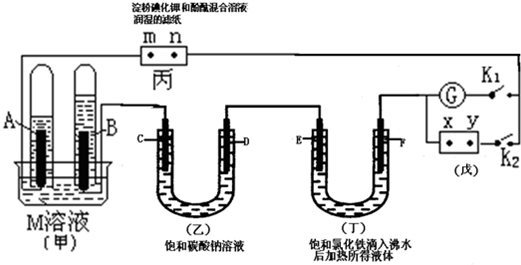
分析 闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,甲中A、B两极应分别生成氢气、氧气,则A为阴极,B为阳极,依次可知d、f、m为阳极,c、e、n为阴极,X为正极、Y为负极,
(1)A、B两极产生的气体体积之比为2:1,则A极是氢气产生,B电极上产生氧气,所以电解质M是电解水型的电解质;
(2)A极是氢气产生,B电极上产生氧气,所以Y是负极,X是正极;
(3)m与正极相连为阳极,碘离子失电子生成单质碘,碘遇到淀粉会变蓝色;
(4)Na2CO3为强碱弱酸盐,水解呈碱性,D电极是阳极,在该极上放电的是氢氧根离子,会产生大量的氧气,同时会产生少量的二氧化碳气体;
(5)饱和的氯化铁加入沸水中会生成氢氧化铁红褐色沉淀,氢氧化铁胶粒带有正电;
(6)形成燃料电池,B为正极.
解答 解:闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,甲中A、B两极应分别生成氢气、氧气,则A为阴极,B为阳极,依次可知d、f、m为阳极,c、e、n为阴极,X为正极、Y为负极,
(1)闭合K2、断开K1,一段时间后,形成串联电解电路,A、B两极产生的气体体积之比为2:1,则A极是氢气产生,B电极上产生氧气,所以电解质M是电解水型的电解质,CE符合,
故答案为:CE;
(2)闭合K2、断开K1,形成串联电解电路,则A极是氢气产生,B电极上产生氧气,所以Y是负极,X是正极,故答案为:正极;
(3)m与正极相连为阳极,碘离子失电子生成单质碘,碘遇到淀粉会变蓝色,电极方程式为2I--2e-=I2,故答案为:2I--2e-=I2;
(4)Na2CO3为强碱弱酸盐,水解呈碱性,在溶液中存在CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-,D电极是阳极,在该极上放电的是氢氧根离子,会产生大量的氧气,同时会产生少量的二氧化碳气体,
故答案为:CO32-+H2O?HCO3-+OH-,HCO3-+H2O?H2CO3+OH-;O2和CO2;
(5)在丁装置中,饱和的氯化铁加入沸水中会生成氢氧化铁红褐色沉淀,再外加电源作用下,会发生电泳,氢氧化铁胶粒带有正电,所以移向阴极,即移向E即,
故答案为:E;
(6)形成燃料电池,B为正极,氧气得到电子生成水,电极方程式为O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-.
点评 本题综合考查原电池和电解池知识,是高考中的常见题型和重要的考点之一,属于中等难度的试题,题目有利于培养学生分析问题、解决问题的能力,也有助于培养学生的逻辑思维能力和发散思维能力,注意根据电解现象判断阴阳极和正负极.


科目:高中化学 来源: 题型:解答题
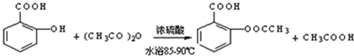
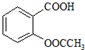 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,制备基本操作流程如图1: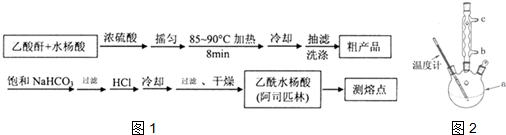
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸 | 102 | 139.4(沸点) | 反应 |
| 乙酸水杨酸 | 180 | 135(熔点) | 微溶 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、HCO3-、Cl- | B. | Fe3+、SCN-、Cl-、NO3- | ||
| C. | Mg2+、Cu2+、SO42-、NO3- | D. | Fe2+、SO42-、H+、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
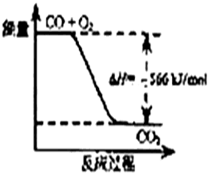
| A. | CO的燃烧热为283 kJ/mol | |
| B. | 图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为1.204×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐可作调味剂,也可用作食品防腐剂 | |
| B. | 二氧化硫可用于制作葡萄酒的食品添加剂 | |
| C. | 还原铁粉和生石灰均可用作食品包装袋内的脱氧剂 | |
| D. | “地沟油”禁止食用,但可用来制取肥皂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 4:3 | C. | 2:1 | D. | 3:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL1mol/L的碳酸钠溶液中含有CO32-为1NA | |
| B. | 常温、常压下,0.5mol臭氧中含有氧原子为1.5NA | |
| C. | 标准状况下,1mol NO2气体与水反应生成NO3-为NA | |
| D. | 78gNa2O2中含有O2-为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com