
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:单选题
| A.2.8 g | B.5.6 g | C.11.2 g | D.1.4 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.0075mol | B.0.0225mol |
| C.0.03mol | D.0.0175mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 mL 2 mol·L-1盐酸充分反应后,溶
mL 2 mol·L-1盐酸充分反应后,溶 液中FeCl2的物质的量为
液中FeCl2的物质的量为| A.0.02mol | B.0.03 mol | C.0.04mol | D.0.06mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 烧杯编号 | ① | ② | ③ |
| 加入试剂 | 铁粉0.1g | 铁粉0.1g,0.1mol/LH2SO43mL | 0.1mol/LH2SO43mL |
| 红色出现时间(天) | 1天 | 4天左右 | 8天以上 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 化合物的性质。过程如下:
化合物的性质。过程如下: H)3具有两性,Cu(OH)2也具有两性吗?
H)3具有两性,Cu(OH)2也具有两性吗?
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.使用硫酸过量 | B.使用铁屑过量 |
| C.使用稀硫酸 | D.使用浓硫酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
|
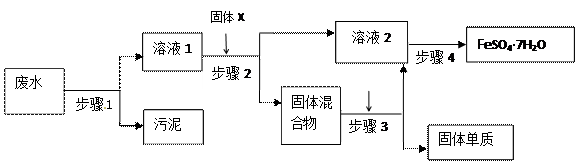 (1)步骤
(1)步骤 1的主要操作是 ,需用到的玻璃仪器有 , _______、 。
1的主要操作是 ,需用到的玻璃仪器有 , _______、 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com