
关于下列诗句或谚语,说法不正确的是
A.“忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关
B.“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
C.“滴水石穿、绳锯木断”不包含化学变化
D.“落汤螃蟹着红袍”肯定发生了化学变化
科目:高中化学 来源:2015-2016学年湖北省高二第一学期第一次月考化学试卷(解析版) 题型:填空题
(12分)某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
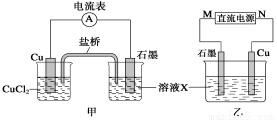
(1)将上述反应设计成原电池如图甲所示,请回答下列问题:
①图中X溶液的溶质是____(填化学式),Cu电极上发生的电极反应方程式为 。
②原电池工作时,盐桥中的_____________ (填“K+”或“Cl-”)不断进入X溶液中。
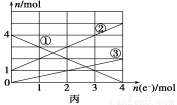
(2)将上述反应设计成电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量关系如图丙,请回答下列问题:
①M是直流电源的__________极;图丙中的②线是_________的物质的量的变化。
②当电子转移为2 mol时,向乙烧杯中加入________ L 5 mol·L-1 NaOH溶液,才能使溶液中所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O Na2FeO4+3H2↑,则电解时阳极的电极反应方程式为__________________________________。
Na2FeO4+3H2↑,则电解时阳极的电极反应方程式为__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高一上期中测试化学试卷(解析版) 题型:选择题
在标准状况下,称量一个充满氯气的容器质量为74.6g,若改充氮气,其质量为66g,则容器的容积为
A.11.2L B.5.6L C.4.48L D.2.24L
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光中学高一上10月月考化学试卷(解析版) 题型:选择题
0.1mol某种金属元素的单质直接与氯气反应后,质量增加7.1g,则这种元素是
A.Na B.H2 C.Fe D.Cu
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期四调考试化学试卷(解析版) 题型:选择题
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示。已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H键所需的能量(kJ)是
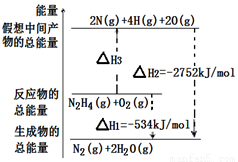
A.194 B.391 C.516 D.658
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第三次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.标准状况下,5.6LCO2与足量Na2O2反应转移的电子数0.25NA
B.室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3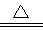 2HNO3↑+4N2+9H2O反应中,生成5.6gN2时,转移电子数目为3.75NA
2HNO3↑+4N2+9H2O反应中,生成5.6gN2时,转移电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省高一上期中测试化学试卷(解析版) 题型:选择题
用NA代表阿伏加德罗常数,下列说法正确的是
A.0.2NA个CO分子在标准状况下的体积约是4.48 L
B.0.1mol/L BaCl2溶液中Cl﹣数目是0.2NA
C.4℃时,22.4 L水中含有的电子数目为10NA个
D.使23g钠变为 Na+,需失去0.1NA个电子
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期期中测试化学试卷(解析版) 题型:填空题
(15分)氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
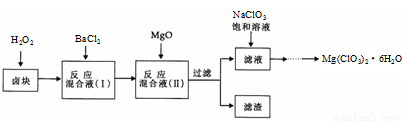
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质②四种化合物的溶解度(S)随温度(T)
变化曲线如图所示。

回答下列问题:
(1)过滤时主要的玻璃仪器有
(2)加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是
(3)加速卤块在H2O2溶液中溶解的措施有: (写出一条即可)
(4)加入MgO的作用是 ;滤渣的主要成分为
(5)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为:MgCl2+2NaClO3= Mg(ClO3)2↓+2NaCl,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(6)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2: 取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ +6Fe3++7H2O。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-)
②产品中Mg(ClO3)2·6H2O的质量分数为(保留一位小数)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南外国语学校高三上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
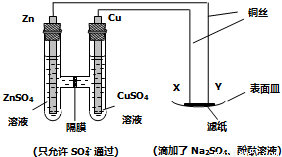
A.Y与滤纸接触处有氧气生成 B.X为正极,发生氧化反应
C.Y为阴极,发生还原反应 D.X与滤纸接触处变红
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com