
A、
| ||
B、
| ||
C、
| ||
D、
|
| Wg |
| Ag/mol |
| W |
| A |
| W |
| A |
| W(A-N+n) |
| A |


科目:高中化学 来源: 题型:
| A、中和1 mol HCl需要NaHCO3 82g |
| B、NaHCO3的速率与HCl的反应速率之比为1:2 |
| C、加入的NaHCO3量可以大大过量 |
| D、84g的NaHCO3可以中和36.5g的胃酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO |
| B、SO2 |
| C、甲醛、甲苯等有机物蒸气 |
| D、臭氧 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
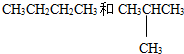 D.甲烷和庚烷E.液氯与氯气
D.甲烷和庚烷E.液氯与氯气 和
和 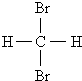
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、试管中滴加溶液时,滴管尖嘴要伸入试管口内,以防溶液滴到试管外 |
| B、不能将滴管水平拿持 |
| C、加完药品后可将滴管放回原瓶 |
| D、滴管除了原滴瓶外,不能放别的地方 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com