
【题目】黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-l
已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-l
②K2S(s)=S(s)+2K(s) △H=bkJ·mol-l
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H=ckJ·mol-l
下列说法正确的是
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol 碳(s)在空气中不完全燃烧生成CO的焓变小于akJ·mol-1
科目:高中化学 来源: 题型:
【题目】实验室利用如图装置进行中和热的测定,请回答下列问题:
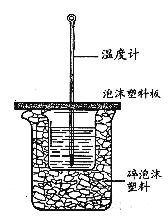
(1)大小烧杯之间填满碎泡沫塑料的作用是___________,做1次完整的中和热测定实验,温度计需使用________次,从实验装置上看,图中缺少的一种玻璃仪器是______________ 。
(2)使用补全仪器后的装置进行实验,取50mL0.25mol/LH2SO4溶液与 50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的比热容c为 4.18J/ (g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= ______ , H2SO4与NaOH反应的热化学方程式_______________ 。
(3)实验中若用60mL0.25mol·L-1H2SO4溶液跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量___________ (填“相等”、“不相等”),所求中和热___________(填“相等”、“不相等”);若用50mL0.50mol·L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会_______。(填“偏大”、“偏小”、“不受影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计如下装置(图中药品均足量):
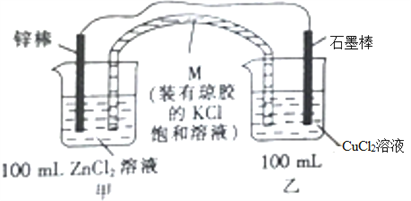
(1)M的名称是_________。
(2)烧杯乙中的现象是_____________________________。
(3)负极的电极反应式为____________________________________________,电池总反应的化学方程式为_____________。
(4)M的作用是向甲、乙两绕杯中提供K+或Cl-,以确保溶液呈电中性。当锌棒质量变化6.5g时,从M中进入装置乙内的离子是__________,其浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
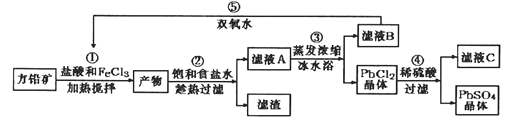
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq) ![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)①中生成淡黄色沉淀的离子方程式是________________________________________________,加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是____________________。
(2)用化学平衡移动的原理解释③中使用冰水浴的原因是__________________
(3)上述流程中可循环利用的物质有_______________。
(4)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:
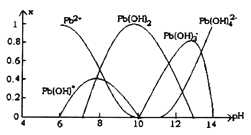
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
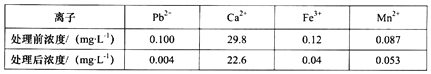
由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,将足量的BaSO4固体溶于50mL水中,充分搅拌,慢慢加入Na2CO3固体,搅拌,溶液中随c(CO32-)增大时c(Ba2+)变化曲线如下图。则下列说正确的是
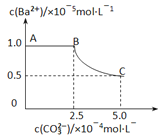
A. 20℃时Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(CO32-):c(SO42-)=25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知磷酸分子(![]() )中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
)中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸( H3 PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能与D2O发生氢交换。下列说法正确的是
A. H3 PO2属于三元酸 B. H3 PO2的结构式为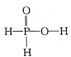
C. NaH2PO2属于酸式盐 D. NaH2PO2溶液可能呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是
A. 赤铁矿的主要成分是FeO
B. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加铁粉,然后过滤
C. 铁与水蒸气在高温下反应的产物为Fe2O3和H2
D. Fe3+与KSCN反应产生红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值.下列说法正确的是( )
A.5.6gFe在氧气中燃烧,完全反应时转移电子数为0.3NA
B.标准状况下,4.48L氦气中所含原子数为0.2NA
C.NA个Fe(OH)3胶体粒子的质量为107g
D.带温下,1.7gNH3和3.65gHCl混合后,气体分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. 饱和NaCl(aq) ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
B. Al2O3![]() AlCl3(aq)
AlCl3(aq) ![]() 无水AlCl3
无水AlCl3
C. H2SO4(浓) ![]() SO2
SO2![]() (NH4)2SO3(aq)
(NH4)2SO3(aq)
D. Cl2(g) ![]() Ca(ClO)2
Ca(ClO)2![]() HClO
HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com