
分析 (1)据n=$\frac{m}{M}$计算;
(2)根据每个分子中含有的原子数计算总原子数;
(3)根据V=nVm计算;
(4)计算溶液和溶质的质量,可计算质量分数.
解答 解:(1)m g某气体的物质的量为$\frac{mg}{Mg/mol}$=$\frac{m}{M}$ mol,
故答案为:$\frac{m}{M}$;
(2)因为一个分子中含两个原子,所以含有的原子数为分子数的2倍,即为2×$\frac{m}{M}$ mol×NAmol-1=$\frac{2m{N}_{A}}{M}$,
故答案为:$\frac{2m{N}_{A}}{M}$;
(3)该体积的体积为$\frac{m}{M}$ mol×22.4L/mol=$\frac{22.4m}{M}$L,
故答案为:$\frac{22.4m}{M}$;
(4)该气体溶于1L水中(不考虑反应),1L水的质量约为1000g,则该溶液中溶质的质量分数为:ω=$\frac{m}{m+1000}$×100%=$\frac{100m}{m+1000}$%,
故答案为:$\frac{100m}{m+1000}$%.
点评 本题考查了有关物质的量的简单计算,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、气体摩尔体积、摩尔质量等物理量之间的转化关系.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:解答题

 、
、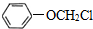 (写两种)
(写两种)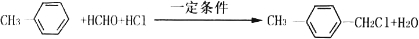 ,
,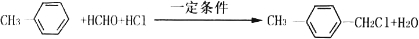 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焊锡(锡铅合金)熔点比金属锡高 | |
| B. | 生成物的能量与反应物的能量一般都不相等 | |
| C. | 使用催化剂,可加快反应速率,但不能改变反应限度 | |
| D. | 用CaSO4可降低盐碱地(含Na2CO3、NaCl)土壤的碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
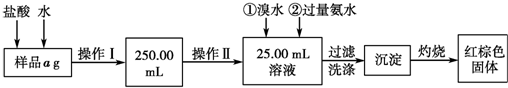
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
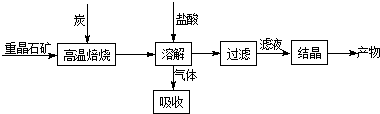
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研制水溶剂涂料替代有机溶剂涂料 | |
| B. | 用可降解塑料生产包装盒或快餐盒 | |
| C. | 用反应:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O 制备硫酸铜 | |
| D. | 用反应:2CH2=CH2+O2$\stackrel{Ag}{→}$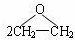 制备环氧乙烷 制备环氧乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2分子比例模型: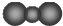 | B. | 硫离子的结构示意图为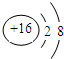 | ||
| C. | NH4Cl的电子式为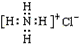 | D. | 中子数为20的氯原子${\;}_{17}^{37}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通入过量的二氧化碳Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫NH3•H2O+SO2═NH4++HSO3- | |
| D. | 硝酸铁溶液加入过量氨水3NH3•H2O+Fe3+═Fe(OH)3↓+3 NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com