
【题目】几种物质的化学式及其名称分别是:Na2S2O3硫代硫酸钠;CaSx多硫化钙;BaO2过氧化钡。根据上述命名规律K2CS3的名称应为( )
A.三硫代碳酸钾 B.多硫碳化钙肥 C.过硫碳酸钾 D.超硫碳酸钾
科目:高中化学 来源: 题型:
【题目】有关下列图像的分析正确的是
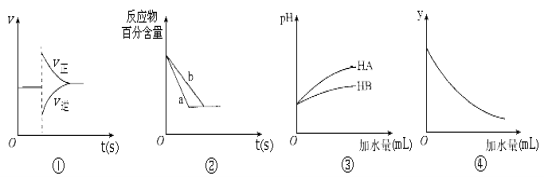
A.图①表示在N2(g)+3H2(g)![]() 2NH3(g)达到平衡后,减少NH3浓度时速率的变化
2NH3(g)达到平衡后,减少NH3浓度时速率的变化
B.图②中a、b曲线分别表示反应H2(g)十I2(g)![]() 2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
2HI(g)在有催化剂和无催化剂存在下建立平衡的过程。
C.图③说明HB是比HA更弱的酸
D.图④中的y可表示将冰醋酸加水稀释时溶液导电能力的变化情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A.lmolNaCl 固体中含有NA个Na+
B.18gD2O和18gH2 O中含有的质子数均为10NA
C.标准状况下2.24LH2O 含有的共价键数为0.2NA
D.密闭容器中2molNO 与lmolO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是A、B、C、D、E五种有机物的有关信息:
A | B | C | D | E |
①是一种烃,能使溴的四氯化碳溶液褪色 ②比例模型为:
③能与水在一定条件下反应生成C | ①由C、H两种元素组成 ②球棍模型为:
| ①能与钠反应,但不能与NaOH溶液反应; ②能与E反应生成相对分子质量为100的酯 | ①由C、H、Br三种元素组成; ②相对分子质量为109 | ①由C、H、O三种元素组成; ②球棍模型为:
|
根据表中信息回答下列问题:
(1)写出A使溴的四氯化碳溶液褪色的化学方程式:__________________;
(2)A与氢气发生加成反应后生成分子F,F的同系物的通式为CnH2n+2。当n =________时,这类有机物开始有同分异构体。
(3)B的分子式为____________,写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:___ ;
(4)C与E反应能生成相对分子质量为100的酯,写出该反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量的铜溶于一定量浓HNO3中,产生NO、N2O4 NO2的混合气体,这些气体若与1.12 LO2(标准状况)混合后通入水中,气体被水完全吸收。若向原所得溶液中加入5mol.L的H2SO4溶液100mL,则继续溶解的铜的质量
A.6.4g B.9.6g C.19.2g D.24g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016年新课标3】下列说法错误的是( )
A.乙烷室温下能与浓盐酸发生取代反应
B.乙烯可以用作生产食品包装材料的原料
C.乙醇室温下在水中的溶解度大于溴乙烷
D.乙酸与甲酸甲酯互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图1所示。其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。
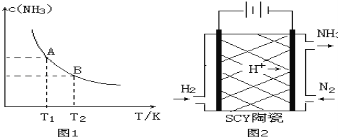
当温度由T1变化到T2时,平衡常数关系K1 K2(填“>”,“<”或“=”)。
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为 。
③T1温度下该反应的化学平衡常数K1= 。
(2)根据最新“人工固氮”的研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g),此反应的△S 0(填“>”或“<”)。
若N2(g)+3H2(g)=2NH3(g) △H=a kJ/mol
2H2(g)+O2(g)=2H2O(l) △H=b kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)的△H= (用含a、b的式子表示)。
(3)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图2所示,则阴极的电极反应式是 。
(4)已知某些弱电解质在水中的电离平衡常数(25℃)如下表:
弱电解质 | H2CO3 | NH3.H2O |
电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Kb=1.77×10-5 |
现有常温下0.1 mol·L-1的(NH4)2CO3溶液,
①该溶液呈 性(填“酸”、“中”、“碱”),原因是 。
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是 。
A.c(NH4+)>c(CO32-)>c(HCO3-)>c(NH3.H2O)
B.c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
C.c(CO32-)+c(HCO3-)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3.H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
E.c(H+)+c(HCO3-)+c(H2CO3)=c(OH-)+c(NH3.H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是
A.Fe -2e-=Fe2+ B.2H2O+O2+4e-=4OH-
C.2H++2e-=H2↑ D.4OH-- 4e-=2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将如图所示实验装置的K闭合,下列判断正确的是( )
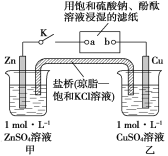
A.电子沿Zn→a→b→Cu路径流动
B.Cu电极上发生还原反应
C.片刻后甲池中c(SO![]() )增大
)增大
D.片刻后可观察到滤纸b点变红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com