
下列试剂的保存方法不正确的是
A.NaOH溶液保存在配有玻璃塞的细口瓶中
B.金属钠通常密封保存在煤油中
C.氯水通常保存在棕色细口瓶并置于阴凉处
D.在盛液溴的试剂瓶中加水,形成“水封”,以减少溴挥发
科目:高中化学 来源: 题型:
已知1~18号元素的离子,aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A.质子数c>d
B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.原子半径X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是
A.C、N、O三种元素第一电离能从大到小的顺序是O>N>C
B.根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
C.根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7
D.Ni原子的核外电子排布式为1s22s23s23p63d84s2
查看答案和解析>>
科目:高中化学 来源: 题型:
下图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )

①食盐水 ②KNO3溶液 ③适量稀硫酸铜溶液
④Na2CO3溶液 ⑤CCl4 ⑥浓氨水
A.①③⑤ B.②⑥
C.③⑤ D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2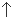 +2H2O。关于该反应的下列说法正确的是( )
+2H2O。关于该反应的下列说法正确的是( )
A.N2既是氧化剂,又是还原剂 B.每生成1molN2转移的电子的物质的量为6mol
C.NH4Cl中的氮元素被还原 D.NaNO2是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列除杂质的操作中不正确的是
A.铁粉中混有铝粉:加入过量烧碱溶液充分反应后过滤
B.FeCl2溶液中混有FeCl3:加入过量铁粉充分反应后过滤
C.Na2CO3固体中混有少量NaHCO3:加入适量NaOH溶液
D.氯气中混有少量氯化氢气体:将混合气体通过盛饱和食盐水的洗气瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
①最外层电子数是2的元素一定是金属元素
②元素周期表中,非金属性最强的元素是F
③盐酸是强酸,H2S是弱酸,故非金属性:Cl>S
④X元素的阳离子和Y元素的阴离子具有相同的电子层结构,则原子序数:X>Y
⑤O2和O3属于同素异形体,故它们的性质相同
⑥H2O稳定的原因是水分子间存在氢键
A.①④⑥ B.①③⑤ C.①③⑤⑥ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定。
Ⅰ.制备Na2S2O3·5H2O
反应原理:Na2SO3(aq)+S(s)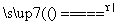 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)硫粉在反应前用乙醇润湿的目的是__________________________。
(2)仪器a的名称是________,其作用是____________________。
(3)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是____________________________。
(4)该实验一般控制在碱性环境下进行,否则产品发黄,用离子反应方程式表示其原因:________________________________________________________________________
________________________________________________________________________。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。
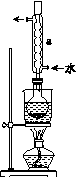
反应原理为2S2O +I2===S4O
+I2===S4O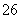 +2I-
+2I-
(5)滴定至终点时,溶液颜色的变化:____________________________________________。
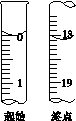
(6)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为__________mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
Ⅲ.Na2S2O3的应用
(7)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO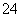 ,常用作脱氯剂,该反应的离子方程式为____________________________________________。
,常用作脱氯剂,该反应的离子方程式为____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com