
【题目】下列离子方程式表达正确的是
A. 泡沫灭火器的灭火原理:2A13+ +3 CO32-+3H2O= 2Al(OH)3↓+ 3CO2↑
B. 小苏打溶液呈碱性的原因:HCO3-+H2O![]() H3O++ CO32-
H3O++ CO32-
C. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
D. 向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH4++Al3++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3·H2O+2H2O
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下左图所示。右图为t2时刻后改变容器中条件,平衡体系中速率随时间变化的情况,且四个阶段都各改变一种条件,所用条件均不同。已知t3-t4阶段为使用催化剂。
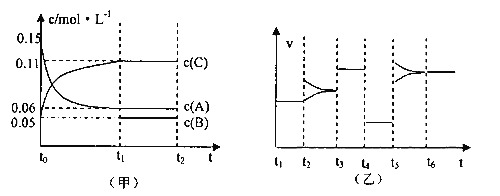
(1)若t1=15s,则t0—t1阶段以C浓度变化表示的反应速率v(C)为=_________________。
(2)若t2—t3阶段,C的体积分数变小,此阶段v(正)_____________v(逆)(填“>”“<”“=”)
(3)t4—t5阶段改变的条件为_________________,B的起始物质量为_________________。
(4)t5—t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①NaHSO4晶体,②液态O2 ,③冰醋酸(固态醋酸), ④汞,⑤BaSO4固体,⑥Fe(OH)3 胶体,⑦酒精(C2H5OH) ,⑧熔化KNO3,⑨盐酸,⑩金属钠,请回答下列问题(用序号):
(1)以上物质中能导电的是__________
(2)以上物质属于电解质的是_____________
(3)以上物质中属于非电解质的是_______
(4)请写出①在熔融状态下的电离方程式________________
(5)a. 写出制备⑥的实验操作为_________;
b. 制备⑥的离子方程式为____________________,
c. 在制得的⑥中逐滴加入稀硫酸的实验现象为_____________________________。
(6)写出⑩在加热条件下与氧气反应的化学方程式________________________。若将2.3克钠放入97.7克水中,生成的溶液中溶质的质量分数_________(填“大于”、“小于” 或“等于”)2.3%。
(7)标准状况下,CO与CO2相对于②的密度为1,则混合气体中CO与CO2的比例为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物H是一种有机光电材料中间体。实验室由芳香化合物A制备H的一种合成路线如下: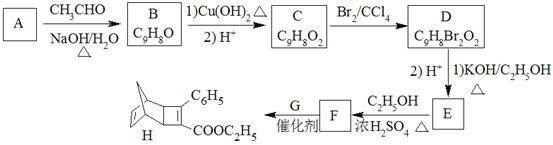
已知:
![]()
![]()
回答下列问题:
(1)A的化学名称为为__________。
(2)由C生成D和E生成F的反应类型分别为__________、_________。
(3)E的结构简式为____________。
(4)G为甲苯的同分异构体,由F生成H的化学方程式为___________。
(5)芳香化合物X是F的同分异构体,X能与饱和碳酸氢钠溶液反应放出CO2,其核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为6∶2∶2∶1,写出2种符合要求的X的结构简式____________。
(6)写出用环戊烷和2-丁炔为原料制备化合物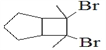 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cl2通入200mL0.5 mol·L-1KOH溶液中,二者恰好完全反应得到KCl、KC1O、KC1O3的混合溶液,经测定C1O-与ClO3-的物质的量之比是1∶2,则通入的Cl2在标谁状况下的体积为
A. 1.12L B. 2.24L C. 1.68L D. 0.56L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氮的化合物引起的环境污染称为氮污染。
(1)己知CO将NO转化为N2的方程式为2CO(g)+2NO(g)![]() N2(g)+2CO2(g) ΔH,某研究小组在实验中研究温度对NO转化率的影响并绘制图像。
N2(g)+2CO2(g) ΔH,某研究小组在实验中研究温度对NO转化率的影响并绘制图像。
①当n(NO)/n(CO)=l,容器容积恒定时,在不同温度下反应相同的时间测得NO的转化率变化如图所示,则在此反应时间内应控制反应的最佳温度在______左右,该反应的ΔH_____0 (填>或<)。

②该反应的平衡常数表达式为K=__________。
要同时提高平衡常数的值和NO的平衡转化率,可采取的措施是________。
A.降低温度 B.及时将CO2和N2从反应体系中移走
C.升高温度 D.增大压强
③在恒温恒容容器中按体积比2∶1充入CO和NO的混合气体,下列选项能说明正反应速率大于逆反应速率的是_____________(填序号)。
A.CO的浓度保持恒定 B.混合气体的平均相对分子质量逐渐减小
C.CO和NO的物质的量之比逐渐增大 D.CO、NO、N2的速率之比为2∶2∶1
(2)在催化剂存在的条件下,用H2可以将NO还原为N2,己知:

则氢气和一氧化氮反应生成氮气和水蒸气的热化学方程式是_________________。
(3)MAP沉淀法是一种比较新颖有效的处理氨氮废水的方法,.原理如下:向含NH4+的废水中投加磷酸盐和镁盐,使之和NH4+生成难溶复盐MgNH4PO4·6H2O (简称MAP)。MAP沉淀法需要控制反应的PH在7.5-10之间,当PH过高时不利于生成MAP的原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2H2(g)+O2(g)=2H2O(g),1molH2完全燃烧放出热量241.8KJ,有关键能数据如下:
化学键 | H-O | O=O |
键能/kJmol﹣1 | 463.4 | 498 |
则H﹣H键键能为( )
A. 413 kJ/mol B. 557 kJ/mol C. 221.6 kJ/mol D. 436 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类正确的是
A. Cu(OH)2难溶于水,属于非电解质
B. SO2能与碱反应生成盐和水,属于酸性氧化物
C. NH4Cl组成中不含金属离子,不属于盐
D. HCl气体溶于水电离成H+和Cl-,属于离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)试剂a是________,固体B是________。(填化学式)
(2)操作④的名称是________________。
(3)加入试剂b时反应方程式为___________________________。
(4)该方案存在一定的不足,不能完全达到实验目的,应如何改进______________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是______的质量(填A、A1、B、C)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com