
【题目】将碘酒滴到切开的苹果断面上,观察到断面变蓝色,说明苹果中含有
A.油脂B.淀粉C.纤维素D.葡萄糖
科目:高中化学 来源: 题型:
【题目】(1)某同学欲配制100 mL 0.10 mol·L-1的CuSO4溶液。以下操作1~5是其配制的过程及示意图:
操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解。
操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中。
操作3:继续向X中加蒸馏水至液面离X的刻度线1~2 cm处。
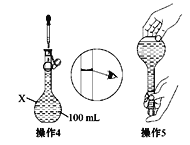
①仪器X的名称是________。称量过程中主要用到的仪器是_____________。在将烧杯中的溶液转移至容量瓶中,为了防止溶液溅出,应采取什么措施____________________。
②关于该配制过程,下列说法正确的是________。
A.操作1中,应称取胆矾晶体的质量为2.5 g
B.操作2中,洗涤液不需要转移到仪器X中
C.操作4称为定容,由于该同学的观察方法不正确,将导致所配溶液浓度偏低
D.操作5摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
(2)为实现金属钠在隔绝空气条件下与水反应并收集生成的气体,某研究性学习小组设计了如图发生装置。

① Y液体可以选用________。
A.煤油 B.饱和的食盐水 C.四氯化碳
②实验前检验该装置气密性的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构、元素周期表和元素周期律,判断下列叙述不正确的是( )
A. 元素钇的一种核素![]() 的质子数与中子数之差为21
的质子数与中子数之差为21
B. 气态氢化物的稳定性:H2O>NH3>SiH4
C. 同主族元素从上到下,单质的熔点逐渐降低
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 能自发进行的反应都是放热反应
B. 凡是熵增加的反应一定能自发进行
C. 在一定条件下,吸热反应可以自发进行
D. 放热的熵增加的反应不一定能够自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:5KI+KIO3+3H2O =3I2+6KOH。其中,还原剂是________(填化学式),被还原的物质是______(填化学式)。若反应中消耗1 mol KIO3,则生成I2____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现在市场上洗衣粉多为加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍、血迹及人体排放的蛋白质油渍遇到它,皆能水解而除去,下列衣料中不能用加酶洗衣粉洗涤的是 ( )
A. 棉织品 B. 毛织品 C. 晴纶织品 D. 人造丝绸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性条件下有以下反应关系: ①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2。②Br2能将I-氧化为I2。③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2。现向含有1 mol KI的硫酸溶液中加入含amol KBrO3的溶液,a的取值不同,所得产物也不同。下列判断正确的是:
编号 | a的取值范围 | 产物的化学式 |
① | a≤1/6 | I2、Br- |
② | 1/6<a<1/5 | I2、Br-、Br2 |
③ | 1/5<a<6/5 | I2、IO3-、Br2 |
④ | a≥6/5 | IO3-、Br2 |
A. ①③④ B. ②③④ C. ①②③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。完成下列填空:
(1)Se和浓HNO3反应的还原产物为NO和NO2,且NO和NO2的物质的量之比为1∶1,写出Se和浓HNO3反应的化学方程式:_________________________________________。
(2)已知:Se+2H2SO4(浓)===2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O===Se+2SO![]() +4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
+4H+。SeO2、H2SO4(浓)、SO2的氧化性由强到弱的顺序是________________________。
(3)回收得到的SeO2的含量,可以通过下面的方法测定:
①____SeO2+____I-+____H+===____Se+____I2+____H2O
②I2+2Na2S2O3===Na2S4O6+2NaI
配平化学方程式①,并标出电子转移的方向和数目。_____________
(4)实验中,准确称量SeO2样品0.150 0 g,消耗了0.200 0 mol·L-1的Na2S2O3溶液25.00 mL,所测样品中SeO2的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)可用作净水剂、除草剂等。某研究小组测定了硫酸矿焙烧后的烧渣中主要成分(Fe2O3、Al2O3和SiO2,不考虑其它杂质)的含量并制备了绿矾,其流程如下:

(1)溶液A中含有的主要阴离子除OH-外还有____________________。
(2)试剂C是__________。
(3)烧渣中Fe2O3、Al2O3和SiO2的物质的量之比是________________。
(4)工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人体及生态系统产生很大的危害,必须进行处理。绿矾还原沉淀法是常用的一种方法:

①已知2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
Cr2O72-(橙色)+H2O。若改变条件使上述平衡向正方向移动,则下列说法正确的是______。
A.达到新平衡后,溶液PH一定增大
B.再达到新平衡前,正反应速率一定大于逆反应速率
C.该反应平衡常数可以不改变
D.达新平衡后,CrO42-的消耗速率等于Cr2O72-的消耗速率
②还原一步的离子方程式是___________________________;若还原l mol Cr2O72-离子,需要FeSO4·7H2O的物质的量是_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com