
氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。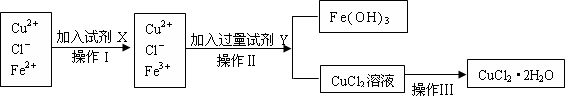
请参照下表给出的数据填空。
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Cu2+ | 4.7 | 6.7 |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
(共14分)⑴加入氧化剂,使Fe2+氧化为Fe3+(2分) ⑵B、D(2分)
⑶CuO(2分);3.2≤pH<4.7(2分)
⑷Cu2+水解:Cu2++2H2O Cu(OH)2+2H+ ,(2分)加入盐酸抑制其水解(1分)。
Cu(OH)2+2H+ ,(2分)加入盐酸抑制其水解(1分)。
⑸CuO(2分),HCl气流中蒸发(1分)。
解析试题分析:由于Fe2+沉淀为Fe(OH)2的pH值与Cu2+沉淀为Cu(OH)2的pH较大,而与Fe3+沉淀为Fe(OH)3的pH相差较大,所以可以通过先将Fe2+氧化为Fe3+,再调节溶液的pH使铁以Fe(OH)3沉淀形式而被除去。为了使加入的氧化剂不带入新的杂质,显然用H2O2最好。出于同样的考虑,加入y调节溶液pH值时,应选用能与H+反应,而溶解度较小的物质如CuO为好,CuO稍多不会带入新杂质也不会使pH值升高太多而使Cu2+沉淀。
(1)根据操作I后离子的变化可知,操作目的是加入氧化剂,将亚铁离子氧化生成铁离子的。
(2)由于在实验中不能再引入新的杂质,所以选项AC不正确;双氧水的还原产物是水、氯气的还原产物是氯离子,不会引入杂质,答案选BD。
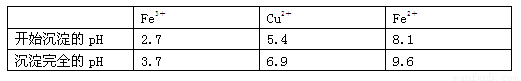
(3)Y试剂的目的是沉淀铁离子,所以加入的试剂应该是氧化铜。铁离子完全沉淀时的pH是3.2,铜离子开始沉淀时的pH是4.7,所以调节溶液的pH应该在3.2≤pH<4.7。
(4)氯化铜溶于水Cu2+水解:Cu2++2H2O Cu(OH)2+2H+ ,所以加入盐酸的目的是抑制其水解。
Cu(OH)2+2H+ ,所以加入盐酸的目的是抑制其水解。
(5)铜离子水解吸热,且生成的氯化氢极易挥发,所以若将CuCl2溶液蒸干得到的固体是氢氧化铜,灼烧得到的是氧化铜。所以要得到氯化铜晶体应该在HCl气流中蒸发。
考点:考查氯化铜晶体制备实验原理的有关判断以及水解原理应用的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固与训练,有利于培养学生规范、严谨的实验设计能力,提升学生的学科素养。该类试题需要注意的是该题需要明确的这种类型的试题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| 实验编号 | 氨水物质的量浓度 (mol?L-1) |
盐酸物质的量浓度 (mol?L-1) |
混合溶液pH |
| ① | 0.1 | 0.1 | pH=5 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH>7 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| ||
| ||
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42- ]?c4(Cl-) |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:


| ||
| ||
| c(CuCl 42- ) |
| c[Cu(H2O) 42+ ]?c4(Cl-) |
| c(CuCl 42- ) |
| c[Cu(H2O) 42+ ]?c4(Cl-) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省南通市海安县高二上学期期末考试化学试卷(带解析) 题型:实验题
(14分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下: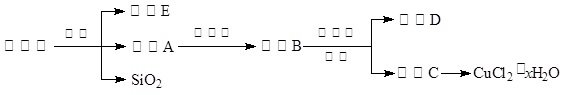
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH: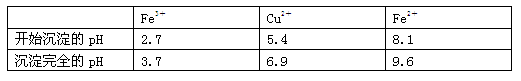
⑴酸溶时,为了提高浸取率可采取的措施有 。(写出一点)
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,通入Cl2发生反应的离子方程式: 。
⑶加入试剂②的目的是调节pH至a,a的范围是 ;
为避免引入杂质离子,试剂②可选用 。
| A.氨水 | B.氧化铜 | C.氢氧化铜 | D.氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源:2014届江苏省南通市海安县高二上学期期末考试化学试卷(解析版) 题型:实验题
(14分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
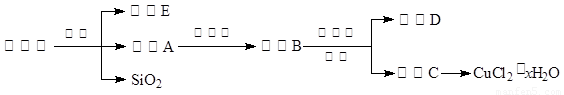
已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH:
⑴酸溶时,为了提高浸取率可采取的措施有 。(写出一点)
⑵若溶液A含有的金属离子有Cu2+、Fe2+,则试剂①为Cl2,通入Cl2发生反应的离子方程式: 。
⑶加入试剂②的目的是调节pH至a,a的范围是 ;
为避免引入杂质离子,试剂②可选用 。
A.氨水 B.氧化铜 C.氢氧化铜 D.氢氧化钠
⑷由溶液C获得CuCl2·xH2O,实验操作依次是加热浓缩、冷却结晶、过滤和洗涤等操作。加热浓缩过程需加入少量盐酸的目的是: 。
⑸工业生产过程会产生含Cu2+的废水,向废水加入碱调节pH=8,沉降后废水中Cu2+浓度为 mol/L。(已知Ksp[Cu(OH)2]=5.6×10-20)
⑹氯化亚铜(CuCl)也是一种重要的化工原料。
制备过程:向CuCl2溶液中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出制备CuCl的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com