
某实验小组欲制取氧化铜并证明氧化铜能加快氯酸钾的分解,进行了如下实验:
Ⅰ.制取氧化铜 ①称取2 gCuSO4·5H2O研细后倒入烧杯,加10 mL蒸馏水溶解;②向上述CuSO4溶液中逐滴加入NaOH溶液,直到不再产生沉淀,然后将所得混合物转移到蒸发皿,加热至沉淀全部变为黑色;③将步骤②所得混合物过滤、洗涤,晾干后研细备用.
回答下列问题:
(1)上述实验步骤中需要使用玻璃棒的是________(填实验序号),步骤①、③中研磨固体所用仪器的名称是________;
(2)步骤③中洗涤沉淀的操作是________
Ⅱ.证明氧化铜能加快氯酸钾的分解并与二氧化锰的催化效果进行比较用如图装置进行实验,实验时均以生成25 mL气体为准,

其它可能影响实验的因素均已忽略,相关数据见下表:

回答下列问题:
(3)上述实验中的“待测数据”指________;
(4)本实验装置图中量气装置B由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管;
(5)若要证明实验⑤中干燥管内收集的气体是O2,可待气体收集结束后,用弹簧夹夹住B中乳胶管,拔去干燥管上单孔橡皮塞,________;
(6)为探究CuO在实验⑤中是否起催化作用,需补做如下实验(无需写出具体操作):
a.________,b.CuO的化学性质有没有改变.
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源:2011-2012学年山西省山大附中高一下学期期末考试化学试卷(带解析) 题型:实验题
某实验小组欲制取乙酸乙酯,设计了如下图所示的装置,请回答有关问题: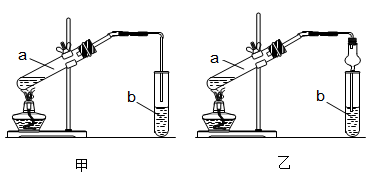
(1)试管a中反应的化学方程式: 。
(2)试管b中盛放的试剂是 。
(3)实验时混合乙醇和浓硫酸的方法是
(4)甲装置试管b中导管未伸入液面下的原因是 ;乙装置中球形干燥管的作用是 ① ② ③ 。
(5)试管b中溶液的主要用途是:
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组设计下图装置制取氯气并以氯气为原料进行实验。
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() (1)装置A烧瓶中发生反应的化学方程式为 ;
(1)装置A烧瓶中发生反应的化学方程式为 ;
![]() (2)装置B中饱和食盐水的作用是 ,装置C中浓硫酸的作用是 ;
(2)装置B中饱和食盐水的作用是 ,装置C中浓硫酸的作用是 ;
![]() (3)实验时,先点燃 处的酒精灯,再点燃 处酒精灯,写出D中反应的化学方程式 ,写出E中反应的离子方程式 ;
(3)实验时,先点燃 处的酒精灯,再点燃 处酒精灯,写出D中反应的化学方程式 ,写出E中反应的离子方程式 ;
![]() (4)若实验中用12mol?L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是:
(4)若实验中用12mol?L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是:
![]() ① ,② 。
① ,② 。
![]() 欲使反应生成Cl2的物质的量最大程度的接近0.03mol,则在装置气密性良好的前提下实验中应采取的措施是 。
欲使反应生成Cl2的物质的量最大程度的接近0.03mol,则在装置气密性良好的前提下实验中应采取的措施是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)某研究性学习小组设计下图装置制取氯气并以氯气为原料进行实验。

![]()
![]()
![]() (1)装置A烧瓶中发生反应的化学方程式为 ;
(1)装置A烧瓶中发生反应的化学方程式为 ;
![]() (2)装置B中饱和食盐水的作用是 ,
(2)装置B中饱和食盐水的作用是 ,
装置C中浓硫酸的作用是 ;
![]() (3)实验时,先点燃 处的酒精灯,再点燃 处酒精灯,写出D中反应的化学方程式 ,写出E中反应的离子方程式 ;
(3)实验时,先点燃 处的酒精灯,再点燃 处酒精灯,写出D中反应的化学方程式 ,写出E中反应的离子方程式 ;
![]() (4)若实验中用12mol?L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是:
(4)若实验中用12mol?L-1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是:
![]() ① ,② 。
① ,② 。
![]() 欲使反应生成Cl2的物质的量最大程度的接近0.03mol,则在装置气密性良好的前提下实验中应采取的措施是
欲使反应生成Cl2的物质的量最大程度的接近0.03mol,则在装置气密性良好的前提下实验中应采取的措施是
。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
实验室中盐酸的用途十分广泛,常常用来制备气体。
(1)某小组同学欲用4 mol/L的盐酸配制230 mL 0.4mol/L 盐酸溶液,需取用4 mol/L盐酸 mL,实验中需要用到的玻璃仪器有 、 、量筒、 烧杯、胶头滴管。
(2)下列实验操作使配制的溶液浓度偏低的是
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
(Ⅱ)(16分)瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气。已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质。( 3Cl2+6KOH ![]() KClO3+5KCl+3H2O )
KClO3+5KCl+3H2O )
 |
图中:A为氯气发生装置;B的试管里盛有15 mL 30% KOH溶液,并置于水浴中;C的试管里盛有15 mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液。
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过 (填仪器名称)向圆底烧瓶中加入适量的浓盐酸。装置A中反应的离子方程式 。
(2) 反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
反应完毕经冷却后,B的试管中有大量晶体析出。右图中符合该晶体溶解度曲线的是 (填编号字母);从B的试管中分离出该晶体的方法是 (填实验操作名称)。该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl2中含有杂质,该杂质成分 (除水蒸气外,填化学式),如何改进 ;
(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为 色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
|
(4)请在装置图方框中画出缺少的实验装置,并注明试剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com