
【题目】国际奥委会公布的违禁药物目前有138种。某种兴奋剂的结构为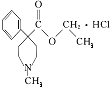 。关于它的说法中正确的是 ( )
。关于它的说法中正确的是 ( )
A. 从结构上看,它属于芳香烃
B. 它的分子中所有的碳原子共平面
C. 该物质的分子式为C14H22ClNO2
D. 1mol该物质最多能与2 mol氢氧化钠反应
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】已知:X、Y、Z、M、N、A 均为中学化学中的常见物质。(部分生成物及条件略去)
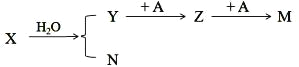
(1)若 X 为红棕色气体,A 为日常生活中应用最广泛的金属,写出 X 与 H2O 反应的化学方程式: __,Z 为_________(写化学式);
(2)若 X 为淡黄色固体,M 为难溶于水的物质,且 X 与 M 具有相同的摩尔质量,则 X 的电子式 _______,A 中参加反应简单阳离子的结构示意图为_________________ ;若 1mol X 与水反应经上述转化,能得到 M 的最大质量__
(3)若 M、N 为同一物质,且为厨房中某常用调味品主要成分。写出 Y 与 N 反应生成 X 的反应类型:_____,检验 Y 中是否混有 M 的简便实验方法___________________________________ .向盛少量 KMnO4 溶液的试管中先滴入少量硫酸,再滴加 Y,充分振荡红色褪去,并生成 M。写出发生反应的离子方程式__________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 10g质量分数为46%的乙醇溶液中,氢原子的总数约为0.6NA
B. 7.8gNa2O2与足量的水(H218O)反应生成的氧气所含的中子数为0.5NA
C. 将1L 0.1mol·L1 FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D. 常温下,NH![]() 数目:1L 0.5mol·L1 NH4Cl溶液大于2L 0.25mol·L1 NH4Cl溶液
数目:1L 0.5mol·L1 NH4Cl溶液大于2L 0.25mol·L1 NH4Cl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双酚—A的二甲基丙烯酸酯是一种能使人及动物的内分泌系统发生紊乱,导致生育及繁殖异常的环境激素,其结构简式为:
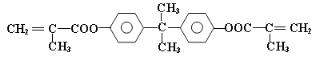
它在一定条件下水解可生成双酚—A和羧酸H两种物质。
I.(1)双酚—A的分子式为____________。下列有关它的叙述中正确的是________。
A.与苯酚互为同系物
B.可以和Na2CO3溶液反应,放出CO2气体
C.分子中最多有13个碳原子在同一平面上
D.1mol 双酚—A与溴水反应,最多消耗Br2的物质的量为4mol
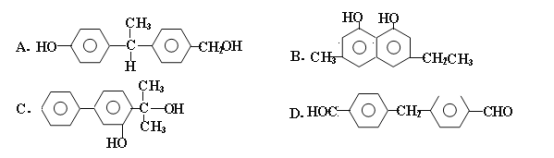
(2)下列物质中与双酚—A互为同分异构体的是_________(填序号)。
II.已知醛能被催化氧化为羧酸。
![]()
羧酸H可以由以下途径制得(有的反应条件没有标出):
![]()
(3)C的结构简式为__________________。
(4)G中所含官能团为____________(填名称),G→H的反应类型为__________。
(5)E→F的化学方程式为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.元素周期表的一部分如下表所示,参照元素①~⑩在表中的位置,请回答下列问题:
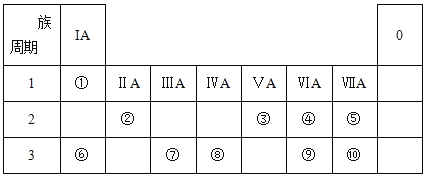
(1)⑨的阴离子结构示意图为____;③的简单氢化物与⑨的最高价氧化物对应的水化物化合生成的正盐的化学式为______。
(2)⑤和⑥形成的化合物的电子式为________。
(3)③、⑧的最高价氧化物对应水化物的酸性由强到弱的顺序为___(用化学式表示,下同)>____。
II.某同学欲利用下图装置验证同周期或同主族元素性质递变规律。
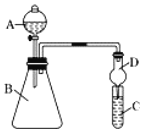
(4)干燥管D的作用是_________。
(5)证明非金属性:Cl>I。在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液变蓝,则C试管中发生反应的离子方程式为________。从环境保护的观点考虑,此装置的缺点是________。
(6)证明非金属性:S>C,在A中加稀硫酸,B中加碳酸钠,C中加澄清石灰水;观察到C中溶液变浑浊的现象,该实验设计的原理是利用_____来比较元素非金属性的强弱。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒.
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有______性.
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2==2ClO2+_____。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,写出化学方程式:_____________
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ加入一定量的Na2S2O3溶液。(已知:2S2O32-+I2== S4O62-+2I-)
Ⅲ加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如图所示:

请回答:
①操作Ⅰ中反应的离子方程式是_____。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是_____。
③若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol/L的Na2S2O3溶液10ml,则水样中ClO2的浓度是_____ mg/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com