
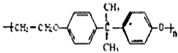
| 1 |
| 2 |
| 催化剂 |
| △ |
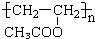 .
.
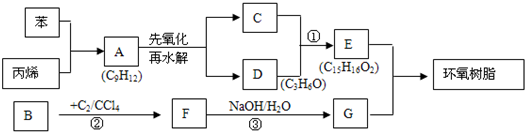
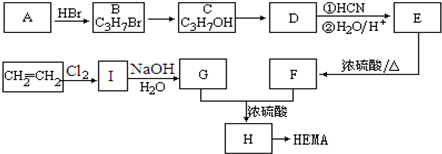
 ,A经氧化后再酸化得到C、D,而C遇FeCl3显紫色,D能加成,但不能发生银镜反应,结合环氧树脂的结构可知,C为
,A经氧化后再酸化得到C、D,而C遇FeCl3显紫色,D能加成,但不能发生银镜反应,结合环氧树脂的结构可知,C为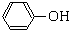 ,D为
,D为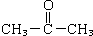 ,G为HOCH2CH2OH,逆推可知F为ClCH2CH2Cl,B为CH2=CH2.
,G为HOCH2CH2OH,逆推可知F为ClCH2CH2Cl,B为CH2=CH2. ,A经氧化后再酸化得到C、D,而C遇FeCl3显紫色,D能加成,但不能发生银镜反应,结合环氧树脂的结构可知,C为
,A经氧化后再酸化得到C、D,而C遇FeCl3显紫色,D能加成,但不能发生银镜反应,结合环氧树脂的结构可知,C为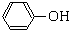 ,D为
,D为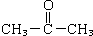 ,G为HOCH2CH2OH,逆推可知F为ClCH2CH2Cl,B为CH2=CH2,
,G为HOCH2CH2OH,逆推可知F为ClCH2CH2Cl,B为CH2=CH2, ,B的结构简式为CH2=CH2,故答案为:
,B的结构简式为CH2=CH2,故答案为: ;CH2=CH2;
;CH2=CH2;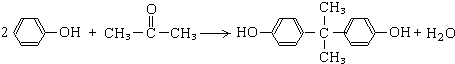 ;
;| 水 |
| △ |
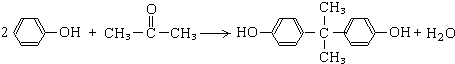 ;
;| 水 |
| △ |
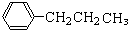 一种;②支链为1个甲基,1个乙基时有
一种;②支链为1个甲基,1个乙基时有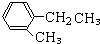 、
、 、
、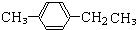 三种;③支链为3个甲基时有
三种;③支链为3个甲基时有 、
、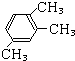 、
、 三种,故共有7种,故答案为:7;
三种,故共有7种,故答案为:7;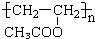 的路线流程图为:
的路线流程图为: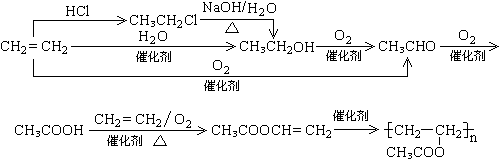 ,
, .
.


科目:高中化学 来源: 题型:
| NH3(g) | O2(g) | NO(g) | H2O(g) | |
| 1mol分子断裂化学键时需要吸收的能量/kJ | a | b | z | d |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
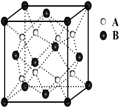 原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:
原子序数依次递增的甲、乙、丙、丁、戊是周期表中前30号元素,其中甲、乙、丙三元素的基态原子2p能级都有单电子,单电子个数分别是2、3、2;丁与戊原子序数相差18,戊元素是周期表中ds区的第一种元素.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W |
| A、Z的气态氢化物比W的气态氢化物稳定 |
| B、原子半径由大到小的顺序为:X>Y |
| C、X元素只能形成一种单质 |
| D、Y元素可形成多种氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
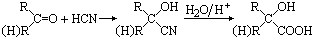
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| C |
| D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com