
【题目】把3molP和2.5molQ置于2L密闭容器中,发生如下反应:3P(g)+Q(g)![]()
![]() xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
xM(g)+2N(g),5min后达到平衡,生成N1mol,经测定M的平均速率是0.1mol/(Lmin),下列叙述错误的是( )
A. P的平均反应速率是0.15mol/(Lmin)
B. Q的转化率是25%
C. Q的平衡浓度是1mol/L
D. x的值为2
科目:高中化学 来源: 题型:
【题目】某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种气体。现将此无色透明的混合气体通过品红溶液后,品红溶液褪色,把剩余气体排入空气中,很快变为红棕色。对于原混合气体成分的判断中正确的是( )
A. 肯定有SO2和NO
B. 肯定没有Cl2、O2和NO2
C. 可能有Cl2和O2
D. 肯定只有NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:
(1)NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为_________________。
(2)一定条件下,在密闭容器中发生反应:2NOCl(g)![]() 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:
序号 | c(NOCl)/(mol·L-1) | v正/(mol·L-1·s-1) |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
则n=_________;k=___________。
(3)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=______kJ/mol;K3=______(用K1和K2表示)。
(4)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=______(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)
的变化如图曲线b所示,则改变的条件是_____________;K3=___________L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种气态烷烃和一种气态烯烃组成的混合物共10g,混合气体的密度是相同状况下H2密度的12.5倍.该混合气体通过装有溴水的试剂瓶时,试剂瓶的质量增加了8.4g,该混合气体可能是( )
A. 乙烷和乙烯 B. 乙烷和乙烯 C. 甲烷和乙烯 D. 甲烷和丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】80 ℃时,将0.4 mol的四氧化二氮气体充入2 L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:
时间/s c(mol·L-1) | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.20 | a | 0.10 | c | d | e |
c(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
反应进行至100 s后将反应混合物的温度降低,发现气体的颜色变浅。
(1)该反应的化学方程式为______________________________________________。
(2)表中b=______,c______d(填“<”“=”或“>”)。
(3)20 s时,N2O4的浓度为______mol·L-1,0~20 s内N2O4的平均反应速率为________。
(4)该反应的平衡常数表达式K=_____,在80 ℃时该反应的平衡常数K值为________。
(5)在其他条件相同时,该反应的K值越大,表明建立平衡时________。
A.N2O4的转化率越高 B.NO2的产量越大
C.N2O4与NO2的浓度之比越大 D.正反应进行的程度越大
E.所耗时间越少 F.容器内气体压强越大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧硫酸亚铁锂电池正极片中的金属,其流程如下:

下列叙述错误的是
A. 合理处理废旧电池有利于保护环境和资源再利用
B. 从“正极片”中可回收的金属元素有Al、Fe、Li
C. “沉淀”反应的金属离子为Fe3+
D. 上述流程中可用硫酸钠代替碳酸钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)在医药、橡胶、印染、食品等方面应用广泛。回答下列问题:
(1)生产Na2S2O5,通常是由NaHSO3过饱和溶液经结晶脱水制得。写出该过程的化学方程式__________。
(2)利用烟道气中的SO2生产Na2S2O5的工艺为:
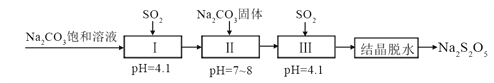
①pH=4.1时,Ⅰ中为__________溶液(写化学式)。
②工艺中加入Na2CO3固体、并再次充入SO2的目的是__________。
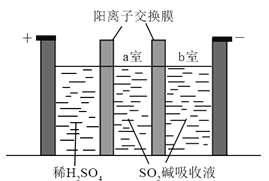
(3)制备Na2S2O5也可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为_____________。电解后,__________室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。
(4)Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00 mL葡萄酒样品,用0.01000 mol·L1的碘标准液滴定至终点,消耗10.00 mL。滴定反应的离子方程式为_____________,该样品中Na2S2O5的残留量为____________g·L1(以SO2计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可绕键轴自由旋转,某烃的结构简式如下图所示,下列说法中正确的是
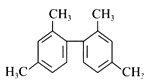
A. 该物质所有原子均可共面
B. 分子中至少有10个碳原子处于同一平面上
C. 分子中至少有11个碳原子处于同一平面上
D. 该烃与苯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型无机材料碳化钛(TiC)、碳化硼(B4C)、氮化硅(Si3N4)等称为非氧化物陶瓷,合成这些物质需在高温条件下进行,在合成工艺中必须注意( )
A.通入充足的氧气B.避免与氧气接触
C.可在氮气气氛中合成D.通入少量氧气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com