
25 ℃时,水电离出的H+浓度是5×10-13 mol·L-1的硫酸溶液中,硫酸溶液的浓度为 ( )
A.0.01mol·L-1 B.0. 02 mol·L-1
C.1×10-7 mol·L-1 D.1×10-12 mol·L-1
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:填空题
Ⅰ、甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
反应Ⅱ:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②反应Ⅰ中,若△H1﹤0,则要提高甲醇的产率,可采取的措施有_____(填字母)
A.缩小容器的体积 B.降低温度 C.升高温度
D.使用合理的催化剂 E.将甲醇从混合体系中分离出来
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H1=-1453kJ/mol
②2CO (g)+O2(g)=2CO2(g) △H2=-466kJ/mol
请写出32g甲醇液体发生不完全燃烧生成一氧化碳和液态水的热化学反应方程式: 。
Ⅱ.由CO2和H2合成CH3OH的反应如下:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H。在10L的恒容密闭容器中投入1 mol CO2和2.75 mol H2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
CH3OH(g)+H2O(g)△H。在10L的恒容密闭容器中投入1 mol CO2和2.75 mol H2,在不同条件下发生上述反应,测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
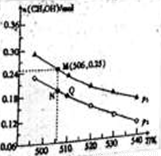
①上述反应的△H (填“﹥”或“﹤”)0
②图中压强p1 (填“﹥”或“﹤”)p2
③经测定知Q点时容器的压强是反应前压强的0.9,若反应从开始到平衡所需的时间为10min,则0~10min内H2的反应速率v(H2)= 。
④N点时,该反应的平衡常数K= (计算结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第五次模拟理综化学试卷(解析版) 题型:实验题
四氯化锡(SnCl4)是合成有机锡化合物的原料,其熔点为-33℃,沸点为114℃,在潮湿的空气中强烈水解产生有刺激性的白色烟雾,产物之一为SnO2.实验室制备四氯化锡的操作是:将金属锡熔融,然后泼入冷水,制成锡花,将干燥的锡花加入反应器中;再向反应器中缓慢地通入干燥的氯气。
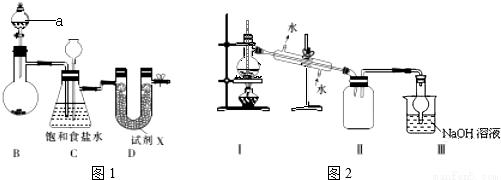
Ⅰ.图1示实验室制备干燥氯气的实验装置(夹持装置己略)
(1)该装置制备氯气选用的药品为漂粉精固体[主要成分Ca(ClO)2]和浓盐酸,A中发生反应的化学方程式为_____________。
(2)装置B中的饱和食盐水能够除去Cl2中的HCl,此外还有_____________作用。
(3)试剂X可能为_____________(填写字母).
A.无水氯化钙 B.浓硫酸 C.碱石灰 D.五氧化二磷
(4)四氯化锡在潮湿空气中水解的化学方程式_____________。
(5)用锡花代替锡粒的目的是_____________。
II.图2是蒸馏SnCl4的装置
(6)该装置尚有两处不当之处,它们分别是_____________、_____________。
(7)实验用的锡花中含有金属铜。甲同学设计下列实验测定锡花的纯度。
第一步:称取7.500g锡花溶于足量稀硫酸中,充分反应后过滤;
第二步:向滤液中加入过量Fe2(SO4)3,将生成的Sn2+氧化成Sn4+;
第三步:用1.000mol/LK2Cr2O7溶液滴定生成的Fe2+,发生反应的方程式为(未配平):
Fe2++Cr2O72-+H+→Cr3++Fe3++H2O
若达到滴定终点时共消耗20.00mlK2Cr2O7溶液,试计算锡花中锡的百分含量_____________(结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三5月一模理综化学试卷(解析版) 题型:选择题
常温下,向10mL某浓度的H2SO3溶液中滴加0.2mol﹒L-1 NaOH溶液,含S微粒的物质的量变化曲线如图所示,下列有关说法正确的是( )
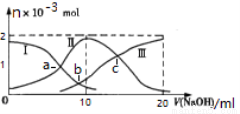
A.曲线Ⅱ代表H2SO3的浓度
B.V(NaOH)=10ml时,溶液温度最高,c(H2SO3)= 0.1mol﹒L-1
C.水的电离程度大小:a点<b点<c点
D.若c点pH=6,则K2(H2SO3)=10—8
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:填空题
某温度下,向某密闭容器中加入1molN2和4molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入的物质的量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:
[1]若X=0,Y=1,则Z= 。
[2]若X=0.75,Y= ,Z=0.5。
[3]X、Y、Z应满足的一般条件是(分别用只含X、Z和只含Y、Z写两个方程式表示) 。
(2)恒定T、P:
[1]若X=1、Y= ,则Z=2。
[2]若X=2,则Y=10,Z= 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:选择题
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是( )
A. V1>V2 B. V1<V2 C. V1=V2 D. V1≤V2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:选择题
下列叙述中,能证明某物质是弱电解质的是( )
A.熔融时不导电
B.水溶液的导电能力很差
C.不是离子化合物,而是极性共价化合物
D.溶液中已电离的离子和未电离的分子共存
查看答案和解析>>
科目:高中化学 来源:2016届山西省等校高三下第四次联考理综化学A卷(解析版) 题型:选择题
常温下,将一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合溶液的pH |
甲 | 0.1 | 0.1 | pH=a |
乙 | 0.2 | 0.2 | pH=9 |
丙 | c1 | 0.2 | pH =7 |
丁 | 0.2 | 0.1 | pH<7 |
下列判断正确的是
A.c1=0.2 B.丁组混合液:c(Na+)>c(A-)>c(H+)>c(OH-)
C.a>9 D.在乙组混合液中由水电离出的c(OH-)=10-5mol·L-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆兵团农二师华山中学高二下期中化学卷(解析版) 题型:填空题
25摄氏度时,现有浓度均为0.10 mol/L的四种溶液:①氨水 ② NaOH溶液 ③CH3COOH溶液 ④盐酸。请回答:
(1)①溶液中c(H+) c(OH-) (填“>”、“<”或“=”)。
(2)醋酸的电离方程式是 。
(3)①对水的电离平衡产生的影响是 ,理由是 。
(4)溶液②和溶液③等体积混合后所得溶液显碱性,原因是 (用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com