
| A. | 实验室用排饱和食盐水的方法收集氯气 | |
| B. | 棕红色的NO2加压后颜色先变深后变浅(已知:2NO2 (g)?N2O4 (g)) | |
| C. | 工业上生产硫酸的过程中,使用过量的空气以提高SO2的利用率 | |
| D. | 用硫酸氢钠去除暖水瓶中的水垢 |
分析 勒沙特列原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒沙特列原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用勒沙特列原理解释.
解答 解:A、氯化钠在溶液中完全电离,所以饱和食盐水中含有大量的氯离子,氯气溶于水的反应是一个可逆反应,Cl2+H2O?ClO-+2H++Cl-,由于饱和食盐水中含有大量的氯离子,相当于氯气溶于水的反应中增加了大量的生成物氯离子,根据勒夏特列原理,平衡向逆反应方向移动,氯气溶解量减小,所以可以勒夏特列原理解释,故A正确;
B、棕红色NO2加压后颜色先变深后变浅,加压先是体积缩小,颜色变深,后平衡正向移动,颜色变浅,故B正确;
C.增大空气的量,平衡向正反应方向移动,所以可以用平衡移动原理解释,故C正确;
D、用硫酸氢钠去除暖水瓶中的水垢,是强酸制弱酸,不是平衡的移动,故D错误;
故选D.
点评 本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应.


科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z<Y<X<W | |
| B. | 气态简单氢化物的稳定性:Y<X | |
| C. | Q和M中的阴、阳离子个数比均为1:2,但化学键种类有差异 | |
| D. | Z与W能形成ZW或Z2W型离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:Z>W | |
| B. | 对应的氢化物的热稳定性:R>W | |
| C. | X与Z、W与Z均以原子个数比1:1形成的化合物中化学键类型不完全相同 | |
| D. | R的最高价氧化物的水化物与NaHYO3溶液反应有气泡生成,证明非金属性:R>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应中,伴随着物质的变化,既有化学键的断裂又有化学键的形成,还有化学能的改变 | |
| B. | 在化学反应过程中是放出热量还是吸收热量,取决于反应物总能量与生成物总能量的相对大小 | |
| C. | 需要加热的化学反应,该化学反应过程一定是吸收能量 | |
| D. | 物质具有的能量越低,其稳定性越大,反应越难以发生;物质具有的能量越高,其稳定性越小,反应越容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 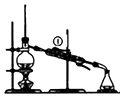 装置A可用于实验室制取蒸馏水,从①处通入冷却水 | |
| B. | 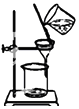 装置B可用于分离汽油和水,且汽油层由分液漏斗的下口放出 | |
| C. | 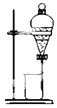 装置C可用于除去固体BaCl2中的BSaO4 | |
| D. | 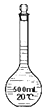 装置D在配制一定物质的量浓度的溶液之前可以有水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据实验①可知溶液中不存CO32-、SiO32- | |
| B. | 该溶液中肯定存在NH4+、Fe2+ | |
| C. | 该溶液中至少含有4种离子 | |
| D. | 另取该溶液,加入适量氯水和淀粉溶液,若溶液显蓝色,即可确定该溶液中只含NH4+、Fe2+、Fe3+、SO42-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| B. | Y的氢化物比R的氢化物稳定,沸点高 | |
| C. | Y分别与Z、W、R以两种元素组成的常见化合物有3种 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com