
| A. | 活化分子间所发生的碰撞都为有效碰撞 | |
| B. | 合成氨工业中用铁触媒做催化剂能用勒夏特列原理解释 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了单位体积内活化分子的百分数 | |
| D. | 将钢闸门与电源的正极相连,是采用了外加电流的阴极保护法 |
分析 A.活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞;
B.勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关、与平衡移动无关,则不能用勒夏特利原理解释;
C.升高温度,活化分子百分数增加,化学反应速率增大;
D.采用外加电流的阴极保护法保护金属时,被保护的金属作阴极.
解答 解:A.活化分子间所发生的分子间的碰撞,只有能发生反应的碰撞才是有效碰撞,故A错误;
B.催化剂只是影响反应速率,不能用勒夏特列原理解释,故B错误;
C.升高温度,增加了单位体积内活化分子百分数,化学反应速率一定能够增大,故C正确;
D.采用外加电流的阴极保护法保护金属时,被保护的金属作阴极,所以钢闸门与电源的负极相连,故D错误;
故选C.
点评 本题考查学生影响化学反应速率的因素中的温度、浓度因素、电解池原理的分析应用,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 常温下,0.1 mol•L-1 HA溶液的pH=3,则HA的电离:HA=H++A- | |
| B. | 用铜电极电解饱和硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向1 mL 2 mol•L-1NaOH溶液中滴加1~2滴0.1 mol•L-1MgCl2溶液后,再滴加2滴0.1 mol•L-1 FeCl3溶液:Mg2++2OH-═Mg(OH)2↓,3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ | |
| D. | 钢铁发生吸氧腐蚀生成铁锈:2Fe+O2+2H2O═2Fe(OH)2,4Fe(OH)2+O2+2H2O═4Fe(OH)3,2Fe(OH)3═Fe2O3•xH2O+(3-x)H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
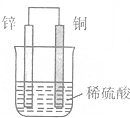
| A. | 锌片上有H2逸出 | B. | 溶液中c(H+)逐渐减小 | ||
| C. | 正极反应式:2H++2e-═H2↑ | D. | 负极反应式:Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在空气中燃烧时,硫的燃烧热小,使化学平衡向有利于生成SO3的方向移动 | |
| B. | 在纯氧气中燃烧时,硫的燃烧热大,不利于化学平衡向生成SO3的方向移动 | |
| C. | 在硫燃烧的过程中,对于SO3的生成,温度的影响大于氧气浓度的影响 | |
| D. | 没有使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在相同条件下的溶解度:NaHCO3>Na2CO3 | |
| B. | 还原性:I->Br->Cl->F- | |
| C. | 氧化性:F2>Cl2>Br2>I2 | |
| D. | 碳酸氢钠溶液与稀盐酸互滴时两种操作现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融NaCl为电解质进行电解冶炼钠,熔融体中Na+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO)•c(S{O}_{3})}{c(N{O}_{2})•c(S{O}_{2})}$的值及SO2转化率不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com