
【题目】如图所示装置中,观察到电流计指针偏转,M棒变粗,N棒变细,由此判断表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A. AB. BC. CD. D
【答案】C
【解析】
电流计指针偏转,说明该装置构成原电池,M棒变粗,N棒变细,则N为易失电子的活泼金属作负极,不活泼金属M作正极,电解质溶液中阳离子为不活泼金属阳离子。
A项、装置中M电极锌比铜活泼作原电池负极,M极变细,铜作原电池正极,正极上氢离子得电子生成氢气,故A不成立;
B项、装置中N电极铁比铜活泼作原电池负极,铜作原电池正极,正极上氢离子得电子生成氢气,M极不会变粗,故B不成立;
C项、装置中N电极锌比银活泼作原电池负极,N极变细,银作原电池正极,正极上银离子得电子生成银,M极变粗,故C成立;
D项、装置中M电极锌比铁活泼作原电池负极,M极变细,铁作原电池正极,正极上三价铁离子得电子生成亚铁离子,故D不成立。
故选C。


科目:高中化学 来源: 题型:
【题目】已知在相同状况下,使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法正确的是( )
A. 电解熔融的Al2O3可以制得金属铝和氧气,该反应是一个放出能量的反应
B. 化合反应一定是放热反应
C. 相同状况下,反应2SO2+O2=2SO3是一个放热反应,则反应2SO3=2SO2+O2一定是一个吸热反应
D. 分解反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。NO2可用下列反应来处理:6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)(放热反应)。
7N2(g)+12H2O(g)(放热反应)。
(1)120℃时,该反应在一容积为2L的容器内反应,2min时达到平衡。10min时氧化产物比还原产物多了1.4g,则0~10 min时,平均反应速率υ(NO2)=_______,电子转移了___NA。
(2)一定条件下上述反应在某体积固定的密闭容器中进行,能说明该反应已经达到平衡状态的________
a.c(NO2):c(NH3)=3:4
b. 6υ(NO2)正 =7υ(N2)逆,
c.容器内气体总压强不再变化
d.容器内气体密度不再变化
(3)若保持其它条件不变,缩小反应容器的体积后达到新的平衡,此时NO2和N2的浓度之比_____(填增大、不变、减小),NO2的转化率______(填増大、不变、减小)。
(4)一定条件下NO2与SO2可发生反应,其化学反应方程式可以表示为:NO2(g)+SO2(g)![]() SO3(g)+NO(g)(吸热反应)。若反应一段时间达到新的平衡时,生成物浓度之积与反应物浓度之积的比值变大,该反应_______(选填编号)
SO3(g)+NO(g)(吸热反应)。若反应一段时间达到新的平衡时,生成物浓度之积与反应物浓度之积的比值变大,该反应_______(选填编号)
a.一定向正反应方向移动 b.平衡移动时,逆反应速率先减小后增大
c.一定向逆反应方向移动 d.平衡移动时,正反应速率先增大后减小
(5)请写出用NaOH溶液完全吸收含等物质的量的NO、NO2混合气体的离子方程式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应速率的叙述不正确的是( )
A.食物放在冰箱中会减慢变质的速率
B.实验室制备CO2时,可通过升高温度来加快反应速率
C.实验室用铁片和稀硫酸制备H2时,选用98%H2SO4能加快反应速率
D.化学反应速率理论是研究怎样在一定时间内快出产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=_______kJ·mol-1。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_________________。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1
②4P(红磷,s)+5O2(g)===2P2O5(s)ΔH2
比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ![]() ,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列的图示与对应的叙述相符的是
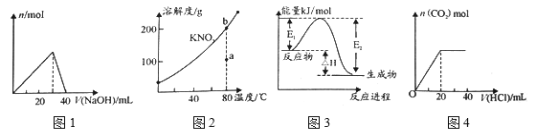
A. 图1表示向l00mL0.l mol·L-l的A1Cl3溶液中滴加1 mol·L-1的NaOH溶液时n [Al(OH)3]的变化情况
B. 图2表示KNO3的溶解度曲线,图中a点表示的溶液通过升温可以得到b点
C. 图3表示某一放热反应,若使用催化剂,E1、E2、△H都会发生改变
D. 图4表示向Na2CO3溶液中滴加稀盐酸时,产生n(CO2)的情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100mL 0.1mol/L AlCl3溶液中,加入1mol/L NaOH溶液v mL后,再滴加1mol/L盐酸。滴加盐酸的体积(横坐标)与生成沉淀的质量(纵坐标)如图示的关系,则加NaOH溶液的体积为( )
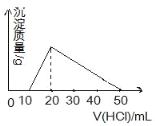
A. 10mL B. 30mL C. 40mL D. 50mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如下。
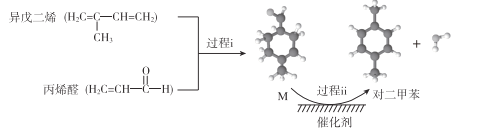
下列说法不正确的是
A. 过程i发生了加成反应
B. 中间产物M的结构简式为![]()
C. 利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯
D. 该合成路线理论上碳原子100%利用,最终得到的产物易分离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com