
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | 2F2+2H2O═4HF+O2 | D. | CaO+H2O═Ca(OH)2 |
分析 该反应中Br元素化合价由0价变为-1价、S元素化合价由+4价变为+6价,水中各元素化合价不变,所以水既不是氧化剂也不是还原剂.
解答 解:A.该反应中Na元素化合价由0价变为+1价、H元素化合价由+1价变为0价,所以水是氧化剂,故A错误;
B.该反应中Fe元素化合价由+2价变为+3价,氧气中氧元素的化合价从0价变为-2价,水中各元素化合价不变,所以水既不是氧化剂也不是还原剂,故B正确;
C.该反应中F元素化合价由0价变为-1价、O元素化合价由-2价变为0价,所以水是还原剂,故C错误;
D.反应中没有元素化合价的变化,不是氧化还原反应,故D错误;
故选B.
点评 本题考查了氧化还原反应,明确元素化合价即可解答,根据元素化合价变化来分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 解释或实验结论 |
| (1)纯净的A为无色粘稠液体, 易溶于水,沸点为380.4℃ | (1)将A从它的水溶液里分离出来 的操作方法是蒸馏. |
| (2)将13.6gA在20.0L纯O2(过量)中充分燃烧 并使反应后的气体依次缓缓通过浓硫酸和碱石灰后, 测得气体体积分别为17.76L和6.56L (所有气体体积均在标准状况下测定). | (2)A的实验式为C5H12O4, A的分子式为C5H12O4. |
(3)A的核磁共振氢谱如图: | (3)A中含有2种氢原 子,A的键线式为 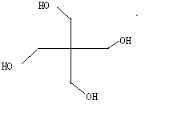 . . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在氧化还原反应中,甲原子失去的电子比乙原子失去的电子多 | |
| B. | 甲、乙氢氧化物溶液的碱性:甲>乙 | |
| C. | 乙能与盐酸反应放出H2,而甲不能 | |
| D. | 将甲、乙作电极组成原电池时,甲为正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其他条件不变时增大压强,能使全气体反应体系中活化分子百分数增加 | |
| B. | 中和反应都是放热反应 | |
| C. | 在FeCl3溶液和KSCN溶液反应的平衡体系中,加入KCl固体,平衡逆向移动 | |
| D. | 熵增大的反应不一定自发,但自发反应熵定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
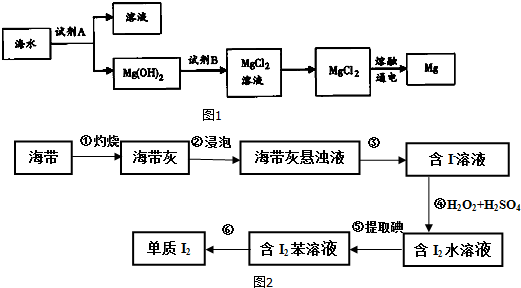
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4在负极发生氧化反应 | |
| B. | 工作一段时间后,电解质溶液中KOH的物质的量减少 | |
| C. | 在标准状况下,通入5.6LO2完全反应后,有1mol电子发生转移 | |
| D. | 该电池工作时,X极附近溶液的碱性增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法、热分解法、热还原法 | B. | 热分解法、电解法、热还原法 | ||
| C. | 热还原法、热分解法、热还原法 | D. | 电解法、电解法、热分解法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
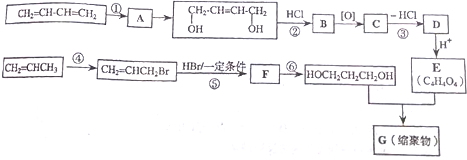
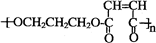 +2nH2O
+2nH2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com