
����Ŀ����֪�Ȼ��������۵�674�桢�е�1023�棻���Ȼ�����300��������������������ˮ������ǿ�ҵ���ˮ�ԣ���500���������Ȼ��������������ܷ������ַ�Ӧ����Ӧ֮һΪ��12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 �� ij�о�С��ѡ������װ�ã��г�װ��ʡ�ԣ�װ�ÿ��ظ�ѡ�ã����з�Ӧ��̽�����ش��������⣺
2Fe2O3+8FeCl3 �� ij�о�С��ѡ������װ�ã��г�װ��ʡ�ԣ�װ�ÿ��ظ�ѡ�ã����з�Ӧ��̽�����ش��������⣺ 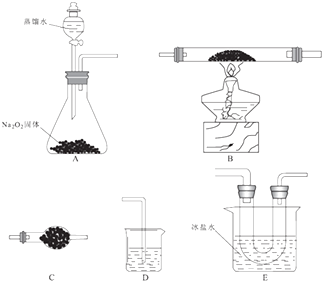
��1��װ�õĺ�������˳��ΪA����D������Eװ��U�ι�������Ϊ�ֵ��ܵ�Ŀ���� ��
��2��Aװ���з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3����Ӧ���̷��֣�װ��B�г����ɺ���ɫ�����⣬���۲쵽����ɫ���壬���ɸ�����Ļ�ѧ����ʽΪ ��
��4����B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ������ ��
��5�����ʵ�飺 ������Eװ��U�ι���Ĺ�����֤Fe��OH��3����� ��
�ڲⶨװ��B�IJ�����������Ԫ�ص����������� ��
���𰸡�
��1��CBEC����ֹFeCl3�����ڵ����У���������
��2��2Na2O2+2H2O=4NaOH+O2��
��3��4FeCl2+3O2 ![]() 2Fe2O3+4Cl2
2Fe2O3+4Cl2
��4��Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ
��5��ȡ���������ˮ�ܽ⣬��pH��ֽ����pH�ƣ������Һ�����ԣ���֤����ȡһ������B�еIJ������壬�������������ᣨ������ȣ��ܽ⣬��������H2O2�������ټ�����������������Һ�ó��������ˡ�ϴ�ӡ��ڿ����г�����������س���
���������⣺��1���Ȼ�������ȡ�Ȼ���������ʵ�飺��Ӧԭ��Ϊ��12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 �� ������ȡ������װ��A��2Na2O2+2H2O=4NaOH+O2������ȡ�������к���ˮ�����������Ȼ���������ˮ������ǿ�ҵ���ˮ�ԣ����ȥ�����е�ˮ������ѡ��װ��C����500���������Ȼ��������������ܷ������ַ�Ӧ��װ��B�У�12FeCl2+3O2
2Fe2O3+8FeCl3 �� ������ȡ������װ��A��2Na2O2+2H2O=4NaOH+O2������ȡ�������к���ˮ�����������Ȼ���������ˮ������ǿ�ҵ���ˮ�ԣ����ȥ�����е�ˮ������ѡ��װ��C����500���������Ȼ��������������ܷ������ַ�Ӧ��װ��B�У�12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 �� ͬʱ��������Ӧ4FeCl2+3O2
2Fe2O3+8FeCl3 �� ͬʱ��������Ӧ4FeCl2+3O2 ![]() 2Fe2O3+4Cl2 �� ��B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ������Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ�����Ȼ�����300������������������װ��EŨ��ˮ��ȴ�Ȼ�����Eװ��U�ι�������Ϊ�ֵ��ܵ�Ŀ���Ƿ�ֹFeCl3�����ڵ����У��������ܣ������װ��Dʢ�ż�����Һ����β���� ���Դ��ǣ�CBEC����ֹFeCl3�����ڵ����У��������ܣ���2��װ��A�й������ƺ�ˮ��Ӧ�����������ƺ���������Ӧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����
2Fe2O3+4Cl2 �� ��B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ������Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ�����Ȼ�����300������������������װ��EŨ��ˮ��ȴ�Ȼ�����Eװ��U�ι�������Ϊ�ֵ��ܵ�Ŀ���Ƿ�ֹFeCl3�����ڵ����У��������ܣ������װ��Dʢ�ż�����Һ����β���� ���Դ��ǣ�CBEC����ֹFeCl3�����ڵ����У��������ܣ���2��װ��A�й������ƺ�ˮ��Ӧ�����������ƺ���������Ӧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����
���Դ��ǣ�2Na2O2+2H2O=4NaOH+O2������3��װ��B�����ɺ���ɫ����Ϊ���������۲쵽����ɫ����Ϊ�������Ȼ�������������Ӧ��������������������Ӧ����ʽΪ��4FeCl2+3O2 ![]() 2Fe2O3+4Cl2 ��
2Fe2O3+4Cl2 ��
���Դ��ǣ�4FeCl2+3O2 ![]() 2Fe2O3+4Cl2����4����B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ��������Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ����֤װ��B�У�12FeCl2+3O2
2Fe2O3+4Cl2����4����B�г�ַ�Ӧ��ֹͣ���Ⱥ������ͨ��������Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ����֤װ��B�У�12FeCl2+3O2 ![]() 2Fe2O3+8FeCl3 �� ��Ӧ��ȫ��
2Fe2O3+8FeCl3 �� ��Ӧ��ȫ��
���Դ��ǣ�Ӳ�ʲ�������ȴ��������װ���еĻ���ɫ������ȫ��ʧ����5������֤Fe��OH��3�������ͨ���Ȼ���Ϊǿ��������ˮ������Խ��м��飬ȡ���������ˮ�ܽ⣬��pH��ֽ����pH�ƣ������Һ�����ԣ���֤��
���Դ��ǣ�ȡ���������ˮ�ܽ⣬��pH��ֽ����pH�ƣ������Һ�����ԣ���֤��
�ڲⶨװ��B�IJ�����������Ԫ�ص�������������ͨ���ⶨ������ʵ�飬����Ϊ����ȡһ������B�еIJ������壬�������������ᣨ������ȣ��ܽ⣬��������H2O2�������ټ�����������������Һ�ó��������ˡ�ϴ�ӡ��ڿ����г�����������س�����
���Դ��ǣ���ȡһ������B�еIJ������壬�������������ᣨ������ȣ��ܽ⣬��������H2O2��������Ҳ�ɣ��ټ�����������������Һ�ó��������ˡ�ϴ�ӡ��ڿ����г�����������س�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ����������ϢϢ��أ���ش���������
��1��ij�¶��£�Kw=1��10��12�� molL��1��2 �� �������¶Ȳ��䣬��ˮ�е���ϡ����ǡ��ʹ��Һ��c��H+��/c��OH����=1��1010 �� ���ʱˮ�������c��H+��=molL��1 ��
��2������������Һ��pH=3��HA��ҺV1 mL��pH=11��NaOH��ҺV2 mL��϶��ã�������˵����ȷ���� ��
A.����Ϻ���Һ�����ԣ���c��H+��+c��OH����=2��10��7mol/L
B.��V1=V2 �� ��Ϻ���Һ��pHһ������7
C.����Ϻ���Һ�����ԣ���V1һ������V2
D.����Ϻ���Һ�ʼ��ԣ���V1һ��С��V2
��3�����������У������������ᣨ�ף�Ka=1.8��10��5 mol/L����һ�����ᣨ�ң�Ka=1.4��10��3 mol/L����ˮ�еĵ������Ũ�ȹ�ϵ���� 
��4��������ʵ���У���֤���������Ա��������������� ��
A.���������pH=4������ʹ���ϡ�ͳ�pH=5����Һ�������������ˮ���Ķ���
B.����������pH������ʹ����зֱ����ͬ������Ӧ���ι��壬����Һ��pH���ޱ仯
C.����������Ũ�ȵ�����ʹ���ֱ��������п�ۣ������������������
D.�õ��������Ũ�ȵ�����ʹ�����������ʵ�飬���ݵ��ݵ������̶ȣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����£�HA�ĵ���ƽ�ⳣ��Ka=6.25��10��5 �� H2CO3�ĵ���ƽ�ⳣ��Ka1=4.17��10��7��Ka2=4.90��10 ��11 �� ������̼�����ϵĹ����У���������NaA�⣬�����ѹ����CO2���壮����˵������ȷ���ǣ������������������ɷ֣��� �� A����ͬ���ʵ���Ũ�ȵ�Na
A.HA�����Һ�ʼ���
B.���CO2����ѹ����̼��������c ��A������С
C.��̼�����ϵ�pHΪ5.0ʱ�� ![]() =0.16
=0.16
D.̼�������и����ӵ�Ũ�ȹ�ϵΪc�� H+��=c�� HCO3����+2c�� CO32����+c��OH������c��HA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йش����Ĵ�����������ɴӡ��Ҵ�������ʵ�顱�õ�һЩ��ʶ����ʵ��װ����ͼ��ʾ��
ʵ�������Ԥ��ʹ���Ž��Ҵ�����ͼ��װ�ã���ͭ˿���м䲿�ּ��ȣ�Ƭ�̺�ʼ�н���(��Ъ��)�ع�����������ɹ۲쵽���Ե�ʵ��������ش��������⣺
��1�������ȵ�ͭ˿��������Ӧ�Ļ�ѧ����ʽΪ��
��2��A���пɹ۲쵽����
���п���ʶ���ڸ�ʵ������д����������ʱ�μ��˻�ѧ��Ӧ��������ʶ�������������ʱ��Ҫһ������
��3��ʵ��һ��ʱ�����������ƾ��ƣ���Ӧ(��ܡ����ܡ�)�������С�ԭ���ȵ�ͭ˿���������� �� ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ʶ������ӻ��������(����)
A. H2SO4��Ba(OH)2��CaCl2��MgO B. NaBr��KNO3��Ca(OH)2��SiO2
C. NaOH��CaO��HCl��CH3COONa D. KOH��(NH4)2SO4��Na2O2��NaH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��8g CH4����mol��ԭ�ӣ�0.1mol NH3����Լ��ԭ�ӣ�ͬ��ͬѹ�£�ͬ�����NH3��H2S�����������Ϊ��ͬ��ͬѹ�£�ͬ������NH3��H2S����������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��C��D��E��F��X��Y���Ƕ��Ե缫���ס�������Һ�������Ũ�ȶ���ͬ������ͨ��ǰ����Һ������䣩��A��BΪ���ֱ����Դ����������ֱ����Դ��ͨ����X����������ɫ��dz��Y����������ɫ�����ش� 
��1�����ס���װ���е�C��D��E��F�缫��ֻ��һ�ֵ�������ʱ����Ӧ���ʵ����ʵ���֮��Ϊ ��
��2�����ñ�װ�ø�ͭ����������������Һ��pH��13ʱ����ʱ����Һ���Ϊ500mL�������жƼ���������������Ϊ ��
��3��Fe��OH��3������Ʊ����ϸ��Ҫ��С������FeCl3��Һ�еμ�NaOH��Һ���Ʊ�Fe��OH��3���壬����ܿ�������˺��ɫ�ij������������Һ��pH=5�����ʱ��Һ��c��Fe3+��=mol/L������֪Ksp=1��10��36����
��4�����ü���ȼ�ϵ�أ��������ҺΪ2L2mol/LKOH��Һ���ṩ��Դ������ͨ����飬�ڱ�״���£����ļ�������VL��������CH4�������44.8��V��89.6ʱ����ʱ��Դ��B�������ĵ缫��ӦΪ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ɢϵ����������ֱ���Ͼ�����ͬ���������ǣ� ��
A.��Һ
B.����
C.����Һ
D.����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��15��Ԫ����Ԫ�����ڱ��е�λ����( )
A. ��2����VA��B. ��2����VIA��C. ��3����VIA��D. ��3����VA��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com