
【题目】CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是![]()
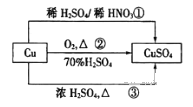
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2:3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mL
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
【答案】D
【解析】物质制备的基本思想是用最少的原料获得最多的产品,同时符合原子利用率高,无污染等要求。途径①的离子方程式为3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O,途径②的反应方程式式为2Cu+O2
3Cu2++2NO↑+4H2O,途径②的反应方程式式为2Cu+O2![]() 2CuO CuO+H2SO4
2CuO CuO+H2SO4![]() CuSO4+H2O,途径③的反应方程式式为Cu+2H2SO4(浓)
CuSO4+H2O,途径③的反应方程式式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,据此可解答。
CuSO4+SO2↑+2H2O,据此可解答。
A、根据途径①的离子方程式可知,H2SO4与HNO3物质的量之比最好为3:2,故A错误;
B、由途径③的化学方程式可得,制备16g硫酸铜即0.1mol,需要消耗硫酸的物质的量为0
.2mol,所以B错误;
C、由反应方程式可知生成等量的硫酸铜,参加反应的硫酸的物质的量为①=②=![]() ③,所以C错误;
③,所以C错误;
D、根据反应方程式可知,制取等量的硫酸铜,途径①与途径②相比,在消耗等量硫酸的基础上又多消耗了硝酸,并生成污染性气体NO,途径③消耗硫酸最多,并产生污染性气体SO2,只有途径②消耗硫酸量少,又不产生污染性气体,所以途径②更好地体现了绿色化学思想,故D正确。本题答案为D。


科目:高中化学 来源: 题型:
【题目】《本草纲目》记载:“烧酒,其法用浓酒和糟入甑,蒸令气上,用器承滴露,”“凡酸坏之酒,皆可蒸烧”。这里用到的实验方法可以用于分离( )
A.植物油和食盐水B.丁醇和乙醚
C.硝酸钾和氯化钠D.碳酸钙和硫酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多变化中存在着能量的变化,请回答下列问题:
(1)从化学键角度上看,化学反应的本质是____________。
已知反应2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
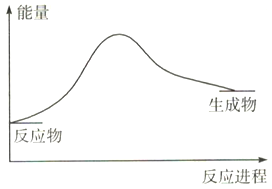
则反应中断裂的化学键是_______(用相应化学键的符号表示),该反应是_____(填“吸热”或“放热”)反应。4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
(2)写出一个属于吸热反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:
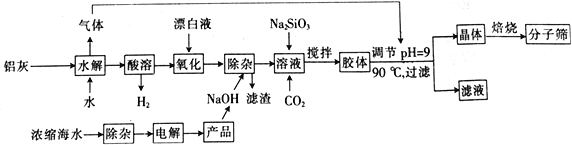
(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式);“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据实验现象所得出的结论中,正确的是( )
A. 无色溶液中加入稀盐酸产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液可能含有CO32-
B. 某物质焰色反应呈黄色,结论:该物质是钠盐
C. 无色试液加入NaOH溶液,加热产生的气体使红色石蕊试纸变蓝,结论:试液中含NH3
D. 无色溶液中加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,结论:原溶液一定含有SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,烧杯甲中盛有少量液态冰醋酸,烧杯乙中盛有NH4Cl晶体,在烧杯乙中再加入适量氢氧化钡晶体[Ba(OH)2·8H2O],搅拌,可观察到冰醋酸逐渐凝结为固体。下列有关判断正确的是( )

A. NH4Cl与Ba(OH)2·8H2O反应的焓变(ΔH)小于0
B. 反应物的总能量高于生成物的总能量
C. 反应中有热能转化为产物内部的能量
D. 反应中断裂的化学键只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式和结论之间的关系正确的是( )
A. 常温常压下,1g H2在足量Cl2中燃烧生成HCl放出92.3kJ的热量,则热化学方程式可表示为H2(g)+Cl2(g)=2HCl(g)△H= -184.6kJ
B. 甲烷的燃烧热为890.3kJ·mol-1则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1,则1molNaOH的稀溶液与足量的稀盐酸完全中和,其中和热为57.3kJ·mol-1
D. 500℃.30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -38.6kJ·mol-1
2NH3(g) △H= -38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有4瓶常用溶液:①BaCl2溶液,②NaCl溶液,③Na2SO4溶液,④CuSO4溶液。不用其他试剂,可通过实验方法将它们一一鉴别开来,鉴别出来的先后顺序可能是( )
A.④①②③B.④②①③C.④①③②D.①④③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种三室微生物燃料电池污水净化系统原理如下图所示,图中含酚废水中有机物可用C6H6O表示,左、中、右室间分别以离子交换膜分隔。下列说法不正确的是( )

A. 左池的pH值降低
B. 右边为阴离子交换膜
C. 右池电极的反应式:2NO3-+10e-+12H+= N2↑+ 6H2O
D. 当消耗0.1molC6H6O,在标准状况下将产生0.28mol氮气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com