
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,11.2 LCH3Cl含极性键数目为2NA
B. 甲基的碳原子杂化轨道类型是sp2,每摩尔甲基含9NA电子
C. 等质量的葡萄糖和乙酸所含碳原子数均为NA/30
D. 有机物(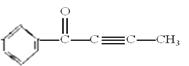 )中最多有6个原子在同一直线上
)中最多有6个原子在同一直线上
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:
【题目】盐酸氯丙嗪是一种多巴胺受体的阻断剂,临床有多种用途。化合物Ⅲ是盐酸氯丙嗪制备的原料,可由化合物I和Ⅱ在铜作催化剂条件下反应制得。
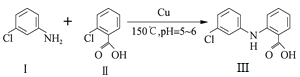
(1) Cu基态核外电子排布式为________________。
(2) 1 mol化合物Ⅰ分子中含有σ键数目为________。
(3) 化合物Ⅲ分子中sp3方式杂化的原子数目是____________。
(4) 向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。分析表明该白色沉淀中Cu、S、N的物质的量之比为1∶1∶1,沉淀中有一种三角锥形的阴离子和一种正四面体形的阳离子。
①[Cu(NH3)4]SO4中存在的化学键类型有________(填字母)。
A.共价键 B.氢键 C.离子键 D.配位键 E. 分子间作用力
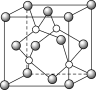
② 铜的氢化物的晶体结构如图所示,写出该晶体的化学式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解
④ 转移、洗涤 ⑤ 定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 mL ,量取浓硫酸所用的量筒的规格是 。
(从下列中选用 A. 10mL B. 25mL C. 50mL D. 100ml)
(2)第③步实验的操作是
。
(3)第⑤步实验的操作是
。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的液凹面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列信息判断氢气燃烧生成水时的热量变化,其中一定正确的是( )
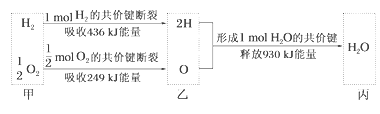
A.生成1molH2O时放出热量245kJ
B.H2O分解为H2与O2时放出热量
C.甲、乙、丙中物质所具有的总能量大小关系为甲>乙>丙
D.氢气和氧气的总能量小于水的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A. CO全部转化为乙醇
B. 正反应和逆反应的化学反应速率均为零
C. 反应体系中乙醇的物质的量浓度不再变化
D. CO和H2以1:2的物质的量之比反应生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如下:
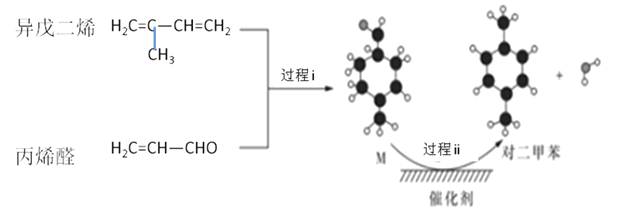
下列说法不正确的是
A. 过程 i 发生了加成反应
B. 利用相同原理以及相同原料,也能合成间二甲苯
C. 中间产物M的结构简式为 ![]()
D. 该合成路线理论上碳原子100%利用,且最终得到的产物可用蒸馏方法分离得到对二甲苯粗产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质![]() 是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热X使之完全分解,发生如下转化:
是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热X使之完全分解,发生如下转化:
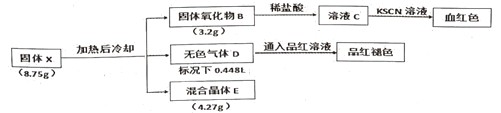
请回答下列问题:
(1)X的化学式为__。
(2)将E混合晶体溶于水配成溶液,向溶液中加入过量稀NaOH溶液时发生的总反应的离子方程式为__。
(3)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,请设计实验方案验证之_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃、101kPa 时,22.4L乙烷中所含共价键数目为6NA
B. 3.2gO2和O3的混合气体中,含氧原子数为0.2NA
C. 12g金刚石含有共价键数目为4NA
D. 1molNaHSO4熔融时电离出的离子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____,与钛同周期的元素中,基态原子的未成对电子数与钛相同的元素分别是____(填元素符号)。
(2)在浓的TiCl 3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1∶5,则该配合物的化学式为______; 1mol该配合物中含有σ键的数目_______。
(3)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
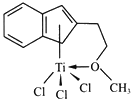
①组成M的元素中,电负性最大的是_________(填名称)。
②M中非金属元素的第一电离能大小顺序_________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(4)金红石(TiO 2)是含钛的主要矿物之一。其晶胞是典型的四方晶系,结构(晶胞中相同位置的原子相同)如图所示。
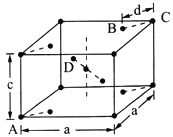
若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com