
【题目】下列离子方程式正确的是
A.NaHSO3溶液中的水解方程式:HSO3+H2O=H3O++![]()
B.FeI2溶液中加双氧水,出现红褐色沉淀:6Fe2++3H2O2=2Fe(OH)3↓+4Fe3+
C.10 mL 0.1 mol·L1 NaOH溶液中滴加几滴AlCl3溶液:Al3++3OH=Al(OH)3↓
D.3a mol CO2通入含2a mol Ba(OH)2的溶液中:3CO2+4OH+Ba2+=BaCO3↓+2![]() +H2O
+H2O
科目:高中化学 来源: 题型:
【题目】在1 L 1 mol·L-1的氨水中,下列说法正确的是( )
A.含1 mol NH3·H2OB.含1 mol![]() 和OH-
和OH-
C.含![]() 和NH3·H2O的和为1 molD.含NH3、NH3·H2O、
和NH3·H2O的和为1 molD.含NH3、NH3·H2O、![]() 之和为1 mol
之和为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g)![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ加入CO0.8mol、Cl20.8mol,达到平衡时CO转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以磷石膏(主要成分是CaSO4,含少量的Al2O3、SiO2等杂质)为原料制备Na2SO4、CaBr2·2H2O和NH4Cl等产品的工艺流程如下:
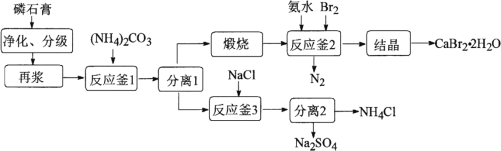
请回答:
(1) 反应釜1中![]() 的浸出率与加料速度、反应温度的关系如下图所示:
的浸出率与加料速度、反应温度的关系如下图所示:
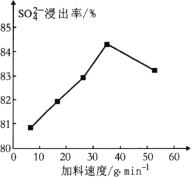
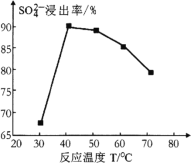
①反应的最佳条件为________。
②其它条件相同时,![]() 浸出率随反应温度先升后降的原因是________。
浸出率随反应温度先升后降的原因是________。
(2) 实验室里模拟上述煅烧操作,下列仪器中有用到的是________。
A 瓷坩埚 B 铁坩埚
C 酒精灯 D 酒精喷灯
(3) 反应釜2中进行的反应是________。
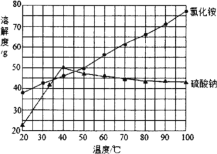
(4) 反应釜3中完成反应后,分离硫酸钠、氯化铵的操作:在90℃左右蒸发浓缩至较多晶体析出→________得到Na2SO4粗品;同时,将热滤液________→得NH4Cl粗品(Na2SO4、NH4Cl的溶解度如图所示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+ H2(g) 在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是 ( )
CO(g)+ H2(g) 在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是 ( )
A.增加H2O的物质的量浓度B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大D.保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】练江整治已刻不容缓,其中以印染工业造成的污染最为严重。某工厂拟综合处理含NH4+ 废水和工业废气(主要含N2、CO2、SO2、NO、CO),设计了如下工业流程:
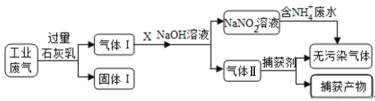
下列说法错误的是
A. 气体I中主要含有的气体有N2、NO、CO
B. X在反应中作氧化剂,可通入过量的空气
C. 处理含NH4+废水时,发生离子方程式是:NH4++NO2-=N2↑+2H2O
D. 捕获剂所捕获的气体主要是CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z是合成平喘药沙丁胺醇的中间体,可通过下列路线制得:
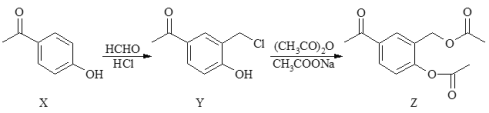
下列说法正确的是
A.X、Y、Z均属于芳香烃B.X分子中所有原子在同一平面上
C.可用FeCl3溶液鉴别Y和ZD.1 mol Z最多能与2 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予在锂电池发展上做出贡献的三位科学家。某可连续工作的液流锂离子储能电池放电时工作原理如图所示,下列说法正确的是
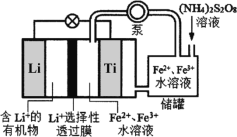
A.放电时,储罐中发生反应:S2O82-+2Fe2+=2Fe3++2SO42-
B.放电时,Li电极发生了还原反应
C.放电时,Ti电极发生的电极方程式为:Fe2+-e=Fe3+
D.Li+选择性透过膜可以通过Li+和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某药物中间体X的合成路线如下:
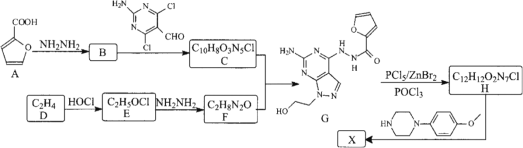
已知:①RX+![]()
![]()
![]() +HX; ②-NH2+RCHO
+HX; ②-NH2+RCHO![]() RCH=N-;
RCH=N-;
③R-OH![]() ; ④
; ④![]()
![]()
![]() 。
。
请回答:
(1) F的结构简式为________。
(2) 下列说法正确的是________。
A H→X的反应类型属于加成反应
B 化合物F具有弱碱性
C 化合物G能发生取代、消去、还原反应
D 化合物X的分子式为C23H27O3N9
(3) 写出B→C的化学方程式________。
(4) ![]() 可以转化为
可以转化为![]() 。设计以苯酚和乙烯为原料制备
。设计以苯酚和乙烯为原料制备![]() 的合成路线(用流程图表示,无机试剂任选)________。
的合成路线(用流程图表示,无机试剂任选)________。
(5) 写出化合物B同时符合下列条件的同分异构体的结构简式。
①分子中有一个六元环,无其它环状结构;________
②1HNMR谱表明分子中有2种氢原子;IR谱显示存在-CN________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com