
 运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:
运用化学反应原理研究物质的性质具有重要意义.请回答下列问题:| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
分析 (1)①CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H1=kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=kJ•mol-1,2×③+②-①得,CO(g)+2H2(g)?CH3OH(g)△H=2△H3+△H2-△H1,据此进行分析;
(2)该反应是个气体体积减小的反应,根据压强对化学平衡的影响分析;
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液,则氢氧根离子少量只与氢离子反应,据此书写离子方程式;
(4)①HSO3-的电离方程式为:HSO3-?H++SO32-,平衡常数表达式为K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$;
②Na2SO3溶液显碱性,SO32-存在两步水解,以第一步水解为主,水解程度较小,据此判断离子浓度关系;
③由表可知H2SO3的二级电离小于H2CO3的一级电离,则酸性强弱H2SO3>H2CO3>HSO3-,据此书写.
解答 解:(1)①CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l)△H1=kJ•mol-1
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H2=kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H3=kJ•mol-1,2×③+②-①得,CO(g)+2H2(g)?CH3OH(g)△H=2△H3+△H2-△H1,
故答案为:2△H3+△H2-△H1;
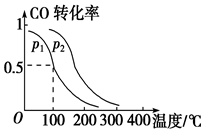
(2)该反应是个气体体积减小的反应,增大压强,化学平衡正向移动,CO的转化率增大,由图1可知相同温度下,p2时CO的转化率大于的p1转化率,故p2大于p1;
故答案为:大于;
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液,则氢氧根离子少量只与氢离子反应,所以离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(4)①HSO3-的电离方程式为:HSO3-?H++SO32-,平衡常数表达式为K=$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$,
故答案为:$\frac{c(S{{O}_{3}}^{2-})c({H}^{+})}{c(HS{{O}_{3}}^{-})}$;
②Na2SO3溶液显碱性,SO32-存在两步水解:SO32-+H2O?HSO3-+OH-,HSO3-+H2O?H2SO3+OH-,以第一步水解为主,水解程度较小,则0.1mol/L Na2SO3溶液中的离子浓度顺序为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),
故答案为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
③由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O,
故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O.
点评 本题考查反应热的计算、离子方程式书写、盐的水解平衡、弱电解质电离平衡的知识在离子浓度大小比较的应用,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 金属钠投入MgCl2溶液中:2Na+Mg2+═2Na++Mg | |
| C. | 0.1mol/LNaHSO4溶液与0.1mol/LBa(OH)2溶液等体积混合:SO42-+Ba2+=BaSO4↓ | |
| D. | 硅酸钠水溶液中通入过量CO2:SiO32-+2H2O+2CO2═2HCO3-+H2SiO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积相同 | |
| B. | 非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 | |
| C. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 | |
| D. | 将CO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学犍 | O=O | C=0 | C≡O |
| 键能(kJ•mol-1) | 497 | 803 | 1072 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
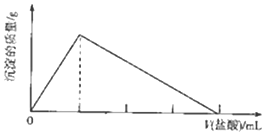 短周期主族元素R、X、Y、Z的原子序数依次增大,R的气态氢化物能使湿润的红色石蕊试纸变蓝色;X原子的核外电子数与价电子数之比为4:3,X和Y组成两种离子化合物,其中一种可作航天器中的供氧剂.向YZX2的溶液中滴加元素,产生沉淀的质量与盐酸体积的关系如图所示.下列说法不正确的是( )
短周期主族元素R、X、Y、Z的原子序数依次增大,R的气态氢化物能使湿润的红色石蕊试纸变蓝色;X原子的核外电子数与价电子数之比为4:3,X和Y组成两种离子化合物,其中一种可作航天器中的供氧剂.向YZX2的溶液中滴加元素,产生沉淀的质量与盐酸体积的关系如图所示.下列说法不正确的是( )| A. | 气态氢化物的稳定性:X>R | |
| B. | 简单离子半径:X>Y>Z | |
| C. | R的最高价氧化物对应的水化物是一种强酸 | |
| D. | 用Z的单质与Y的氧化物反应可冶炼Y的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入适量NaA固体,若溶液pH不变,则HA为强酸 | |
| B. | 若HA为弱酸,则该溶液导电能力比等体积pH=5的盐酸弱得多 | |
| C. | 若HA为弱酸,则加入等体积pH=9的NaOH溶液,所得溶液pH>7 | |
| D. | 取该溶液1.00mL,加水稀释至1000mL,所得溶液pH=8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com