

| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||


 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
 以海水中常见物质A为原料可以发展很多工业,图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题.
以海水中常见物质A为原料可以发展很多工业,图中包含了中学课本中介绍的几种基本工业生产,请根据各物质之间的转化关系回答下列问题.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| 溶解 |
| ||
| 过滤 |
| ||
| 洗涤 |
| 低温烘干、冷却、称量 |
m-
| ||
| m |
m-
| ||
| m |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉市四校高三10月联考化学试卷(解析版) 题型:填空题
(9分)以海水中常见物质A为原料可以发展很多工业生产,下图中包含了中学课本中介绍的几种基本工业生产,请根据下图各物质之间的转化关系回答下列问题。
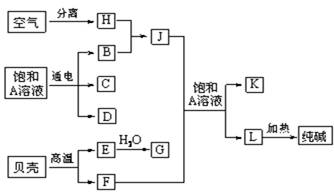
(1) C和D、C和G反应都可以制取消毒剂。写出C和G反应制取消毒剂的化学反应方程式: 。
(2) 电解A溶液反应的离子方程式为___________________________。
若该反应中转移电子数为8NA,则产生的氯气在标准状况下体积为 L
(3) J分子的空间构型为______________________
(4)实验室可用K与G固体加热制取J,写出该反应化学方程式:_______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com