
����Ŀ��Ϊ��̽����ѧ��Ӧ����ЧӦ��ij��ȤС�����������ʵ�飺
��1��������������![]() �ֱ�װ����ˮ����ƿ�������ѧ��Ӧ��������������U�ιܵ����ӣ�����U�ι��ں�īˮ��Һ��߶���ͼ��ʾ��
�ֱ�װ����ˮ����ƿ�������ѧ��Ӧ��������������U�ιܵ����ӣ�����U�ι��ں�īˮ��Һ��߶���ͼ��ʾ��
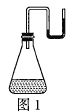

������ͼ1��ʾ�������ķ�Ӧ������û���������ɣ���________������ȡ������ȡ�����Ӧ��![]() ��________�����������ʵĻ�ѧʽ����
��________�����������ʵĻ�ѧʽ����
������ͼ2��ʾ�������ķ�Ӧ������û���������ɣ���________������ȡ������ȡ�����Ӧ������ѡ�������������仯��ͬ����________������ţ���
A ![]() ��ԭ
��ԭ![]() �ķ�Ӧ B
�ķ�Ӧ B ![]() �ķֽⷴӦ C
�ķֽⷴӦ C ![]() ��
��![]() �ķ�Ӧ
�ķ�Ӧ
��2����ͼ3��ʾ�����Թܷ���ʢ��25�汥�ͳ���ʯ��ˮ���ձ��У��Թ��п�ʼ�ż�С����Ƭ���ٵ���![]() ϡ
ϡ![]() ��Һ���Իش��������⣺
��Һ���Իش��������⣺
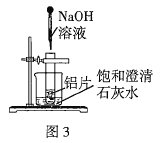
��ʵ���й۲쵽�������ǣ���Ƭ���ܽ⡢�д������ݲ�����______��
�ڲ������������ԭ����___________��
���𰸡����� ![]() ��
��![]() ��
��![]() �������ּ��ɣ� ���� B ���ͳ���ʯ��ˮ�г��ְ�ɫ���� ����
�������ּ��ɣ� ���� B ���ͳ���ʯ��ˮ�г��ְ�ɫ���� ����![]() ��Һ��Ӧ����
��Һ��Ӧ����![]() ���Ҹ÷�Ӧ�Ƿ��ȷ�Ӧ��
���Ҹ÷�Ӧ�Ƿ��ȷ�Ӧ��![]() ���ܽ�����¶ȵ����߶�����
���ܽ�����¶ȵ����߶�����
��������
ͼ1��2ͨ��U�ι��ں�īˮ�仯���ж���ϵ��ѹǿ��������ѹ��Դ�С�������жϷ�Ӧ����ЧӦ���⣨2�����Թܷ���ʢ��25�汥�ͳ���ʯ��ˮ���ձ��У����Թ��з��뼸С����Ƭ���ٵ���![]() ϡ
ϡ![]() ��Һ������
��Һ������![]() ��Һ��Ӧ����������
��Һ��Ӧ����������
��1��������ͼ1��ʾ����ϵ��ѹǿ����������ѹ��˵����ϵ���������ͣ���Ӧ���ȣ�������![]() ������
������![]() ��
��![]() ��
��![]() �ȣ�
�ȣ�
������ͼ2��ʾ����ϵ��ѹǿС��������ѹ��˵����ϵ�����������С����Ӧ���ȣ�![]() ��ԭ
��ԭ![]() �ķ�ӦΪ���ȷ�Ӧ��
�ķ�ӦΪ���ȷ�Ӧ��![]() �ķֽⷴӦΪ���ȷ�Ӧ��
�ķֽⷴӦΪ���ȷ�Ӧ��![]() ��
��![]() �ķ�ӦΪ���ȷ�Ӧ����ѡB��
�ķ�ӦΪ���ȷ�Ӧ����ѡB��
��2�����Թܷ���ʢ��25�汥�ͳ���ʯ��ˮ���ձ��У����Թ��з��뼸С����Ƭ���ٵ���![]() ϡ
ϡ![]() ��Һ������
��Һ������![]() ��Һ��Ӧ����
��Һ��Ӧ����![]() �Ҹ÷�Ӧ�Ƿ��ȷ�Ӧ��
�Ҹ÷�Ӧ�Ƿ��ȷ�Ӧ��![]() ���ܽ�����¶ȵ����߶����ͣ��ձ��еı��ͳ���ʯ��ˮ�л���ְ�ɫ���ǡ�
���ܽ�����¶ȵ����߶����ͣ��ձ��еı��ͳ���ʯ��ˮ�л���ְ�ɫ���ǡ�


 ��ĩ1�����ʽ���������ϵ�д�
��ĩ1�����ʽ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ����գ�
��1�����и��Ϲ����ŵĸ����л��������ž��и��ԵĶ����ԣ��ڲ�ͬ�����������еĻ�ѧ���ʿɷֱ�Ӹ����������ۡ���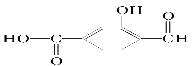 �������ֹ����ţ�______��__________��__________(������ŵ�����)���������������ɿ���______�࣬______���______�ࡣ
�������ֹ����ţ�______��__________��__________(������ŵ�����)���������������ɿ���______�࣬______���______�ࡣ
��2���ǻ��ĵ���ʽ��___________________________��
��3��(CH3CH2)2C(CH3)2������Ϊ_________________________��
��4��2-��-1��3-����ϩ�ļ���ʽ___________________________��
��5��![]() ���л�����Ӿ۷�Ӧ�����ò���Ľṹ��Ϊ______��
���л�����Ӿ۷�Ӧ�����ò���Ľṹ��Ϊ______��
��6��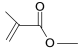 ����ʽΪ_______________________�ṹ��ʽΪ______________________��
����ʽΪ_______________________�ṹ��ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣� ��Ա��е���������Ԫ��,��д���пհף�
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
1 | �� | |||||||
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | ||||
4 | �� |
(1)д������Ԫ�ص�Ԫ�ط��ţ� ��_________���� __________(�����Ԫ�ط��ţ���ͬ)������һ�������ӵĽṹʾ��ͼ��________________��
(2)����������������������Ԫ����___________����������������Ӧˮ������ݵ�����������Ӧˮ������Һ��Ӧ�����ӷ���ʽΪ_______________________________��
(3)��������Ԫ���γɵ��������ĽṹʽΪ________________________���û���������_________���������������Ǽ����������γɵġ�
(4)�ܢ߶���Ԫ���зǽ�����ǿ����___________��
(5)����Ԫ�آ�ķ�����_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ C��C ���������Ƽ�����ת��ij���Ľṹ��ʽ��ͼ������˵������ȷ����
![]()
A. �����ں˴Ź����������� 6���źŷ�
B. 1mol������ȫȼ������16.5mol O2
C. ������������ 10��̼ԭ�Ӵ���ͬһƽ����
D. �����DZ���ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Դ����ϡ���Ϣһ�𱻳�Ϊ�ִ���ᷢչ������֧���������Դ�ݽߵ�Σ���������Դ�����ʺͿ�������Դ�ǽ����һ�����������Ҫ����
(1)��ѧ��Ӧ���ʺ���������������������أ����ǻ�ѧѧ�ƹ�ע�ķ���֮һ��ijѧ��Ϊ��̽��п�����ᷴӦ�����е����ʱ仯����400mLϡ�����м���������п�ۣ�����ˮ���ռ���Ӧ�ų���������ʵ���¼����(�ۼ�ֵ):
ʱ��/min | 1 | 2 | 3 | 4 | 5 |
�������/mL(���) | 100 | 240 | 464 | 576 | 620 |
����һ��ʱ���ڷ�Ӧ�������__________min(����0��1����1��2����2��3����3��4������4��5��)��
����һѧ��Ϊ���Ʒ�Ӧ���ʷ�ֹ��Ӧ�������Բ�������������������������м���������������Һ�Լ�����Ӧ���ʵ���Ӱ��������������������Ϊ���е���____________(����ĸ���)��
A��KCl��Һ B��Ũ���� C������ˮ D��CuSO4��Һ
(2)��ͼΪԭ���װ��ʾ��ͼ��

�ٽ���Ƭ��ͭƬ�õ���������һ�����Ũ�����У�һ������ռ���Һ�У��ֱ��γ���ԭ��أ���������ԭ����У��������ķֱ���_______(����ĸ)��
A����Ƭ��ͭƬ B��ͭƬ����Ƭ
C����Ƭ����Ƭ D��ͭƬ��ͭƬ
д������Ũ������Һ���γɵ�ԭ��صĸ�����Ӧʽ��_______________��
����AΪCu��BΪʯī�������ΪFeCl3��Һ������ʱ���ܷ�ӦΪ2FeCl3+Cu=2FeCl2+CuCl2��д��B�缫��Ӧʽ��________���õ���ڹ���ʱ��A�缫��������_____(��������������С������������)�����õ�ط�Ӧ������0.1mol FeCl3����ת�Ƶ��ӵ���ĿΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�����и���������ָ����Һ��һ���ܴ����������
A. ���д���NO3������Һ��H+��NH4+��I-��S2O32-
B. ������Һ��Fe3+��Al3+��NO3-��SO42-
C. ![]() =1��10-12����Һ��K+��AlO2-��CO32-��Na+
=1��10-12����Һ��K+��AlO2-��CO32-��Na+
D. ��ˮ�������c(H+)=10-12mol/L����Һ��Na+��K+��CO32-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��300 mLAl2(SO4)3��Һ�У���Al3+1.62 g���ڸ���Һ�м���0.1molL��1Ba(OH)2��Һ100mL����Ӧ����Һ��SO42-�����ʵ���Ũ��ԼΪ( )
A. 0.4molL��1B. 0.3molL��1C. 0.2molL��1D. 0.1molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪N2+3H2![]() 2NH3Ϊ���ȷ�Ӧ���Ը÷�Ӧ������˵������ȷ����
2NH3Ϊ���ȷ�Ӧ���Ը÷�Ӧ������˵������ȷ����
A.N2������һ������NH3
B.H2������һ������NH3
C.N2��H2��������һ������NH3��������
D.��÷�ӦΪ���ȷ�Ӧ���ʲ��ؼ��ȾͿɷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Fritz Haber�ںϳɰ�����Ĺ�����Ѿ�110���꣬����Ԫ�ؼ��仯����Ӧ�ù㷺��
(1)�ڻ�̬13Nԭ���У��������__________�������෴�ĵ��ӣ��������ռ�ݵ�����ܼ��ĵ���������ͼΪ__________�Ρ�
(2)���ݼ۲���ӶԻ������ۣ�NH3��NO3-��NO2-�У�����ԭ�Ӽ۲���Ӷ�����ͬ�������������ӵ���________����NO3-��Ϊ�ȵ�����ķ���Ϊ__________��Һ���д��ڵ���ƽ��2NH3![]() NH4+��NH2-�����ݼ۲���ӶԻ������ۣ�����֪NH2-�Ŀռ乹��Ϊ__________��Һ����ϵ�ڣ���ԭ�ӵ��ӻ��������Ϊ________��NH3��PH3������Һ����ԭ��Ϊ__________________��
NH4+��NH2-�����ݼ۲���ӶԻ������ۣ�����֪NH2-�Ŀռ乹��Ϊ__________��Һ����ϵ�ڣ���ԭ�ӵ��ӻ��������Ϊ________��NH3��PH3������Һ����ԭ��Ϊ__________________��
(3)�ҹ���ѧ������ʵ�������״�ȫ��������(N5-)������Co(N5)2(H2O)4��4H2O�ĺϳɣ���ṹ��ͼ��ʾ����֪N5-�Ļ�ѧ��������______________��
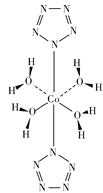
(4)���ض����ʵ���֮�ȵ�NH4Cl��HgCl2���ܷ����һ�����ʱ�����ɾ���X���侧���Ľṹͼ������������ͼ��ʾ������X�Ļ�ѧʽΪ__________���侧���ܶ�Ϊ__________(�谢���ӵ�������ֵΪNA���г�����ʽ)g��cm��3��
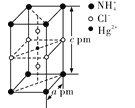
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com