
科目:高中化学 来源:2015-2016学年福建省福安市高二上学期第一次月考化学试卷(解析版) 题型:填空题
(17分)甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料。甲醇在各个领域有着广泛的应用。
(1)实验测得:32 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出726.4 kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________。
(2)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。下图是一个化学过程的示意图。2CH3OH+3O2+4KOH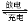 K2CO3+6H2O
K2CO3+6H2O
①A(石墨)电极的名称是 。
②通入O2的电极的电极反应式是________________
③写出通入CH3OH的电极的电极反应式是 。
④乙池中反应的化学方程式为 。
⑤当电路中通过0.01mol电子时,丙池溶液的C(H+) = mol/L(忽略电解过程中溶液体积的变化)。
(3)合成甲醇的主要反应是:2H2(g)+ CO(g) CH3OH(g) △H=—90.8 kJ·mol—1。
CH3OH(g) △H=—90.8 kJ·mol—1。
①在恒温恒容条件下,充入一定量的H2和CO,发生反应2H2(g)+ CO(g) CH3OH(g)。则该反应达到平衡状态的标志有
CH3OH(g)。则该反应达到平衡状态的标志有
a.混合气体的密度保持不变 b.混合气体的总压强保持不变
c.CO的质量分数保持不变 d.甲醇的浓度保持不变
e.v正(H2)= v逆(CH3OH) f.v(CO)= v(CH3OH)
②要提高反应2H2(g)+ CO(g) CH3OH(g)中CO的转化率,可以采取的措施是:
CH3OH(g)中CO的转化率,可以采取的措施是:
a.升温 b.加入催化剂
c.增加CO的浓度 d.加入H2
e.加入惰性气体 f.分离出甲醇
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第二次月考化学试卷(解析版) 题型:选择题
已知298.15 K时,可逆反应:(aq)+Sn(s) Pb(s)+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是
Pb(s)+(aq)的平衡常数K=2.2,若溶液中Pb2+和Sn2+的浓度均为0.10 mol·L-1,则此时反应进行的方向是
A.向正反应方向进行 B.向逆反应方向进行
C.处于平衡状态 D.无法判断
查看答案和解析>>
科目:高中化学 来源:2016届江西省红色七校高三上学期第一次联考化学试卷(解析版) 题型:选择题
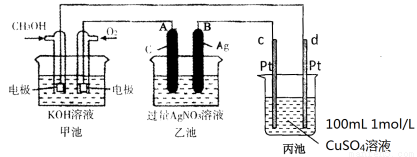
下图是A、B两种重要的有机合成原料。下列有关说法中正确的是
A.A与B互为同系物
B.A与B都能与溴的四氯化碳溶液发生加成反应
C.在一定条件下,A与B均能发生取代反应
D.A与B都能与碳酸氢钠反应产生氢气
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高一上学期第一次月考化学试卷(解析版) 题型:实验题
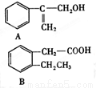
(8分)为证明Na2O2可作为潜水艇的供氧剂,某化学小组在实验室模拟CO2与Na2O2反应产生氧气的实验。
(1)生成CO2的化学反应方程式:
(2)饱和碳酸氢钠溶液的作用是除去CO2中混有的HCl气体,浓H2SO4的作用是
(3)u形管中的现象是 ,反应方程式为
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省临沂市高二上10月月考化学试卷(解析版) 题型:选择题
化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,下列叙述中正确的是

A.每生成2个分子AB吸收(a﹣b) kJ热量
B.该反应热△H=+(a﹣b)kJ·mol﹣1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1mol A﹣A和1mol B﹣B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源:2016届湖南省常德市高三上学期10月月考化学试卷(解析版) 题型:选择题
乌洛托品在合成、医药、染料等工业中有广泛用途,其结构式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比为
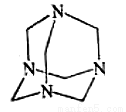
A.1:1 B.2:3 C.3:2 D.2:1
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上学期二次模拟测试理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
金属铝、铁、铜与人类生产、生活息息相关。
(1)聚合硫酸铁(简称PFS)的化学式为[Fe(OH)n(SO4)(3-n)/2]m是常用的水处理剂,与PFS中铁元素价态相同的铁离子的电子排布式为
(2)下列关于[Cu(NH3)4]SO4、K4[Fe(CN)6]、Na3A1F6的说法中正确的有__________(填正确答案标号);
a.三种物质中含有的化学键类型均有离子键和配位键
b.[Cu(NH3)4]SO4中含有NH3分子,其水溶液中也含有大量NH3分子
c.三种物质的组成元素中第一电离能最大的是氮元素
d.K4[Fe(CN)6]与Na3AIF6的中心离子具有相同的配位数
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因_____________,
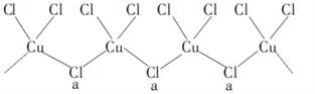
(4)氯和钾与不同价态的铜可生成两种化合物,其阴离子均为无限长链结构(如图所示),a位置上的Cl原子的杂化轨道类型为 _________________ 。已知其中一种化合物的化学式为KCuCl3,则另一种化合物的化学式为________________;
(5)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。对金属铜的测定得到以下结果:铜晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.0g·cm-3,则铜原子的直径约为 pm,阿伏加德罗常数的值为 (列式计算,结果保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第一次月考化学试卷(解析版) 题型:填空题
在25mL的氢氧化钠溶液中逐滴加入0.2 mol/ L醋酸溶液,滴定曲线如图所示。
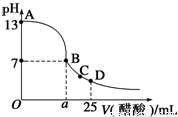
(1)写出氢氧化钠溶液与醋酸溶液反应的离子方程式___________________。
(2)该氢氧化钠溶液浓度为_______________。
(3)在B点,a___ _____12.5 mL(填“<”“>”或“=”)。
若由体积相等的氢氧化钠溶液和醋酸溶液混合且恰好呈中性,则混合前c(NaOH) c(CH3COOH),混合前酸中c(H +)和碱中的c(OH -)的关系:c(H +) c(OH -)(填“<”“>”或“=”)。
(4)在D点,溶液中离子浓度大小关系为______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com