
| 编号 | 0.01mol/LNaHSO3溶液(mL) | 0.01mol/LKIO3溶液(mL) | H2O(mL) | 反应温度(℃) | 溶液变蓝所用时间t/s |
| ① | 6.0 | 10.0 | 4.0 | 15 | t1 |
| ② | 6.0 | 14.0 | 0 | 15 | t2 |
| ③ | 6.0 | a | b | 25 | t3 |
分析 根据表格,对比①②的数据,可以看出KIO3的浓度不一样,其它条件都一样,据此判断实验目的;浓度越大,反应速率越快,需要的时间则越小;实验①③是探究温度对反应速率的影响,所以此时两个实验中的浓度都应当相等,据此答题.
解答 解:根据表格,对比①②的数据,可以看出KIO3的浓度不一样,所以实验①②是探究浓度对反应速率的影响;
由于浓度越大,反应速率越快,则t2较小;
实验①③是探究温度对反应速率的影响,所以此时两个实验中的浓度都应当相等,所以a=10.0、b=4.0,
故答案为:KIO3溶液的浓度;>;10.0;4.0.
点评 本题考查了探究影响化学反应速率的因素的方法,题目难度中等,明确实验目的及对比实验的设计方法为解答关键,试题侧重考查学生的分析、理解能力及灵活应用能力,注意熟练掌握温度、催化剂、浓度等因素对化学反应速率的影响.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,5.2g乙炔和苯的混合气体中含有的碳原子数为0.4NA | |
| B. | 标准状况下,2.24L氖气所含原子数为0.2NA | |
| C. | 1mol硫酸氢钠固体中含阳离子总数2 NA | |
| D. | 5.6g Fe与足量的水蒸气完全反应,转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | |||||||
| B | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 强电解质 | NaCl | H2SO4 | HClO | HNO3 |
| 弱电解质 | HF | BaSO4 | CaCO3 | CH3COOH |
| 非电解质 | Cl2 | CS2 | C2H5OH | SO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
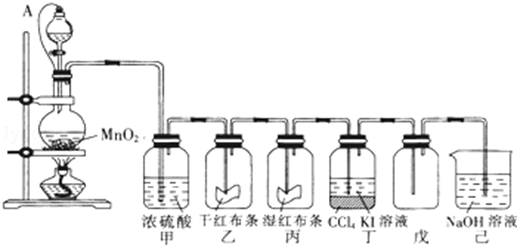
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2项 | B. | 3项 | C. | 4项 | D. | 5项 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
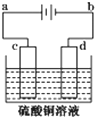 (1)电镀时,镀件与电源的负极连接.
(1)电镀时,镀件与电源的负极连接.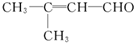 含氧官能团有醛基.
含氧官能团有醛基.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com