
科学家一直致力于“人工固氮”的新方法研究。
 (1)目前合成氨技术原理为:N2(g) + 3H2(g)
(1)目前合成氨技术原理为:N2(g) + 3H2(g) 2NH3(g);
2NH3(g);
△H=—92.4kJ·mol—1。
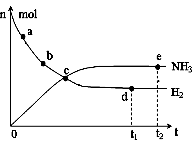
① 673K,30MPa下,上述合成氨反应中n(NH3)和n(H2)随
时间变化的关系如右图所示。下列叙述正确的是 。
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d和点 e处的n(N2)相同
D.773K,30MPa下,反应至t2时刻达到平衡,则n(NH3)比图中e点的值大
② 在容积为2.0 L恒容的密闭容器中充入0.80 mol N2(g)和1.60 mol H2(g),反应在673K、30MPa下达到平衡时,NH3的体积分数为20%。该条件下反应N2(g) + 3H2(g)
 2NH3(g)的平衡常数K= 。K值越大,表明反应达到平衡时 。(填标号)。
2NH3(g)的平衡常数K= 。K值越大,表明反应达到平衡时 。(填标号)。
A.化学反应速率越大 B.NH3的产量一定越大 C.正反应进行得越完全
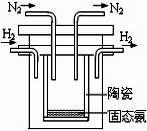 (2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性
(2)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性
的 SCY陶瓷(能传递H+),实现了高温常压下高转化率的电
解合成氨。其实验装置如图,阴极的电极反应式 。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,
N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)
+ 3H2O(1)  2NH3(g)
+
2NH3(g)
+ 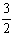 O2(g)
△H = a kJ·mol—1
O2(g)
△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6mol) |
4.8 |
5.9 |
6.0 |
①此合成反应的a 0;ΔS 0(填“>”、“<”或“=”);该反应属于
A.一定自发 B.一定不自发 C.高温自发 D.低温自发
②已知:N2(g)
+ 3H2(g) 2NH3(g)
ΔH= -92 .4kJ·mol—1
2NH3(g)
ΔH= -92 .4kJ·mol—1
2H2(g) + O2(g) = 2H2O(l) = -571.6kJ·mol—1
则N2(g)
+ 3H2O(1) = 2NH3(g) + 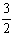 O2(g)
ΔH= kJ·mol—1。
O2(g)
ΔH= kJ·mol—1。
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案科目:高中化学 来源:广东省高考真题 题型:填空题


 。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算
。设在容积为2.0 L的密 闭容器中充人0. 60 mol N2(g)和l.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。计算  的平衡常数。
的平衡常数。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com