
【题目】请同学们根据官能团的不同对下列有机物进行分类。
①CH3CH2OH②![]() ③CH3CH2Br④
③CH3CH2Br④ ![]() ⑤
⑤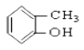 ⑥
⑥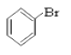 ⑦CH3CHO ⑧
⑦CH3CHO ⑧![]() ⑨
⑨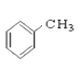 ⑩
⑩ 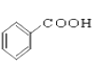
(1)芳香烃:______________;
(2)卤代烃:_______________;
(3)醇:______________;
(4)酚:______________;
(5)醛:______________ ;
(6)酯:______________。
科目:高中化学 来源: 题型:
【题目】纯铜在工业上主要用来制造导线、电器元件等,铜能形成+1和+2价的化合物。回答下列问题:
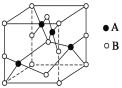
(1)写出基态Cu+的核外电子排布式:______;C、N、O三种元素的第一电离能由大到小的顺序是______
(2)如图是铜的某种氧化物的晶胞示意图,该氧化物的化学式为__________。
(3)向硫酸铜溶液中滴加氨水会生成蓝色沉淀,在滴加氨水至沉淀刚好全部溶解时可得到蓝色溶液,继续向其中加入极性较小的乙醇可以生成深蓝色的[Cu(NH3)4]SO4·H2O沉淀。该深蓝色沉淀中的NH3通过___键与中心离子Cu2+结合;NH3分子中N原子的杂化方式是____与NH3分子互为等电子体的一种微粒是________(任写一种)。
(4)CuO的熔点比CuCl的熔点________(填“高”或“低”)。
(5)CuO在高温下易转化为Cu2O,其原因是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,探究铜与稀HNO3的反应过程如图:
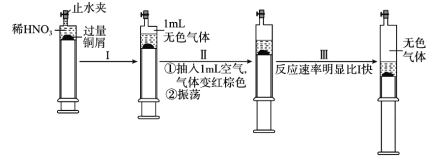
下列说法不正确的是( )
A.过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
B.步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,打开止水夹,滴加稀硫酸,铜可以继续溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁香油酚的结构简式如图所示,从它的结构简式可推测它不可能有的化学性质是 ( )
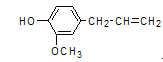
A. 既可燃烧,也可使酸性KMnO4溶液褪色
B. 可与NaHCO3溶液反应放出CO2气体
C. 可与FeCl3溶液发生显色反应
D. 既可与Br2发生加成反应又可发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为:
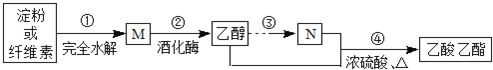
下列说法正确的是( )
A.淀粉与纤维素互为同分异构体
B.M的分子式为C12H22O11
C.N的结构简式为C2H4O2
D.④的反应类型属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如图所示。
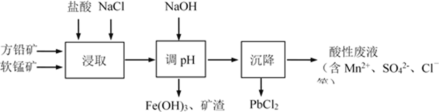
已知:i.PbCl2微溶于水
ii.PbCl2(s) + 2Cl-(aq)PbCl42-(aq) ΔH>0
下列说法不正确的是( )
A.浸取过程中MnO2与PbS发生反应的离子方程式为:8H++2Cl-+PbS + 4MnO2=PbCl2 +4Mn2++SO42-+4H2O
B.PbCl2微溶于水,浸取剂中加入饱和NaCl溶液会增大其溶解性
C.调pH的目的是除去Fe3+,因此pH越大越好
D.沉降池中获得PbCl2采取的措施有加水稀释、降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组经查阅资料得知常温下过量的氨气和氯气能反应生成氯化铵,该实验小组对该反应进行探究,部分实验装置如下(夹持装置略去)
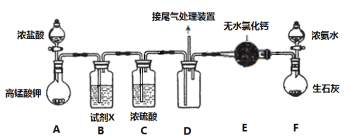
回答下列问题
(1)装置F是NH3的制备装置,其中盛放浓氨水的仪器名称是___________,再写出一种在实验室制备NH3的反应原理(用化学方程式表示)____________。
(2)某同学认为应将E中的无水氯化钙换成碱石灰,他的理由______________。
(3)装置A中发生反应的离子方程式为___________。
(4)装置B中盛装的试剂X的名称为_________,该装置的作用为__________。
(5)装置D的设计中有明显不足之处,请提出改进意见______________。
(6)某同学设计实验证明装置D中所得固体为氯化铵,请把实验步骤写完整:
①取少量装置D中所得固体产物配成溶液,并取少量溶液于两支试管中;
②__________________________;
③向另一只试管中加过量稀硝酸,再加AgNO3溶液,有白色沉淀生成,结论:常温下过量的氨气和氯气反应可生成氯化铵。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于取代反应的是
A. CH2=CH2 + H2O![]() CH3CH2OH
CH3CH2OH
B. ![]() +Br2
+Br2![]()
![]() +HBr
+HBr
C. 2CH3CH2OH![]() C2H5—O—C2H5 + H2O
C2H5—O—C2H5 + H2O
D. ![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeSO4 溶液放置在空气中容易变质,因此为了方便使用 Fe2+,实验室中常保存硫酸亚铁铵晶体[俗称“摩尔盐”,化学式为(NH4)2Fe(SO4)26H2O],它比绿矾或绿矾溶液更稳定。(稳定是指物质放置 在空气中不易发生各种化学反应而变质)
I.硫酸亚铁铵晶体的制备与检验
(1)某兴趣小组设计实验制备硫酸亚铁铵晶体。
本实验中,配制溶液以及后续使用到的蒸馏水都必须煮沸、冷却后再使用,这样处理蒸馏水的目的是_______。向 FeSO4 溶液中加入饱和(NH4)2SO4 溶液,经过操作_______、冷却结晶、过滤、洗涤和干燥后得到一 种浅蓝绿色的晶体。
(2)该小组同学继续设计实验证明所制得晶体的成分。
①如图所示实验的目的是_______,C 装置的作用是_______。
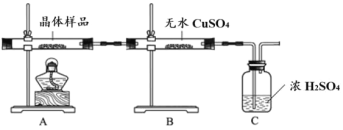
取少量晶体溶于水,得淡绿色待测液。
②取少量待测液,_______ (填操作与现象),证明所制得的晶体中有 Fe2+。
③取少量待测液,经其它实验证明晶体中有NH4+和SO42-
II.实验探究影响溶液中 Fe2+稳定性的因素
(3)配制 0.8 mol/L 的 FeSO4 溶液(pH=4.5)和 0.8 mol/L 的(NH4)2Fe(SO4)2 溶液(pH=4.0),各取 2 ml 上述溶液于两支试管中,刚开始两种溶液都是浅绿色,分别同时滴加 2 滴 0.01mol/L 的 KSCN 溶液,15 分钟后观察可见:(NH4)2Fe(SO4)2溶液仍然为浅绿色透明澄清溶液;FeSO4溶液则出现淡黄色浑浊。
(资料 1)
沉淀 | Fe(OH)2 | Fe(OH)3 |
开始沉淀pH | 7.6 | 2.7 |
完全沉淀pH | 9.6 | 3.7 |
①请用离子方程式解释 FeSO4 溶液产生淡黄色浑浊的原因_______。
②讨论影响 Fe2+稳定性的因素,小组同学提出以下 3 种假设:
假设 1:其它条件相同时,NH4+的存在使(NH4)2Fe(SO4)2 溶液中 Fe2+稳定性较好。
假设 2:其它条件相同时,在一定 pH 范围内,溶液 pH 越小 Fe2+稳定性越好。
假设 3:_______。
(4)小组同学用如图装置(G为灵敏电流计),滴入适量的硫酸溶液分 别控制溶液 A(0.2 mol/L NaCl)和溶液 B(0.1mol/L FeSO4)为不同的 pH,

观察记录电流计读数,对假设 2 进行实验研究,实验结果如表所示。
序号 | A:0.2mol·L-1NaCl | B:0.1mol·L-1FeSO4 | 电流计读数 |
实验1 | pH=1 | pH=5 | 8.4 |
实验2 | pH=1 | pH=1 | 6.5 |
实验3 | pH=6 | pH=5 | 7.8 |
实验4 | pH=6 | pH=1 | 5.5 |
(资料 2)原电池装置中,其它条件相同时,负极反应物的还原性越强或正极反应物的氧化性越强,该原 电池的电流越大。
(资料 3)常温下,0.1mol/L pH=1 的 FeSO4 溶液比 pH=5 的 FeSO4 溶液稳定性更好。 根据以上实验结果和资料信息,经小组讨论可以得出以下结论:
①U 型管中左池的电极反应式____________。
②对比实验 1 和 2(或 3 和 4) ,在一定 pH 范围内,可得出的结论为____________。
③对比实验____________和____________,还可得出在一定pH 范围内溶液酸碱性变化对 O2 氧化性强弱的影响因素。
④ 对(资料 3)实验事实的解释为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com