
| A.W2-、X+ | B.X+、Y3+ | C.X+、Z2- | D.Y3+、Z2- |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加热蒸干灼烧FeCl3溶液,最后所得固体为Fe(OH)3 |
| B.将pH=4的醋酸溶液稀释后,溶液中所有离子浓度都降低 |
| C.pH相同,体积相同的醋酸溶液和稀硫酸分别与足量锌充分反应,产生氢气的量相同 |
| D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的碱性:NaA<NaB |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶10∶100∶1 000 | B.0∶1∶12∶11 |
| C.14∶13∶12∶11 | D.14∶13∶2∶3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化石能源物质内部蕴涵着大量的能量 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能“贮存”起来 |
| C.物质的化学能可以在不同的条件下转化为热能、电能被人类利用 |
| D.吸热反应没有利用价值 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.PH相等的①CH3COONa②C6H5ONa③NaHCO3溶液中,C(Na+)大小关系:①>③>② |
| B.向氨水中滴加稀硫酸至溶液呈中性:C(NH4+)>C(SO42-)>C(OH-)=C(H+) |
| C.向1L 0.1mol/L的NaOH溶液中通入6.6gCO2:2C(Na+)=3[C(CO32-)+C(HCO3-)+C(H2CO3)] |
| D.CH3COONa溶液中加入少量KNO3后的碱性溶液一定有:C(Na+)+C(H+)=C(CH3COO-)+C(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
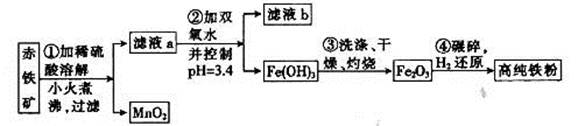
 Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
Fe2O3、3.6% FeO,还含有Al2O3、MnO2、CuO等。
 Cu(OH) 2+2H+的平衡常数K=_______。
Cu(OH) 2+2H+的平衡常数K=_______。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com