
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料出现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其它稀土原料。
(1) 钕(Nd)为60号元素,在元素周期表中的位置是_____;基态铁原子的外围电子排布图是______。
(2)实验测得气态A1C13的实际存在形式为A12C16双聚分子,其中A1原子的杂化方式是__________;A12C16与过量NaOH溶液反应生成Na[Al(OH)4];[A1(OH)4]-中存在的化学键有______(填选项字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)已知立方BN晶体硬而脆,其原因是_______;其晶胞结构如图所示,N原子填充在B原子构成的正四面体空隙中,则晶胞中正四面体的空隙填充率为_______,设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为b gcm-3,则阿伏加德罗常数为_____mol-1 (列式即可,用含a、b的代数式表示)
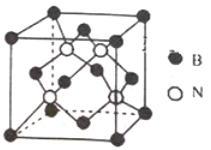
【答案】第六周期Ⅲ B族 ![]() sp3 BC BN为原子晶体,B-N键能大,因此质地坚硬,其共价键具有方向性,受到外力时,会发生原子错位,因此脆 50%
sp3 BC BN为原子晶体,B-N键能大,因此质地坚硬,其共价键具有方向性,受到外力时,会发生原子错位,因此脆 50% ![]()
【解析】
(1)60号元素位于元素周期表第六周期Ⅲ B族;铁为过渡元素,其外围电子包括最外层电子和次外层d能级上的电子,其外围电子排布式图为![]() ;
;
(2)Al2Cl6的结构式为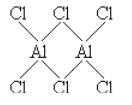 ,即Al的杂化类型为sp3;[Al(OH)4]-中O和H之间为共价键,Al3+与OH-之间以配位键的形式结合,答案选BC;
,即Al的杂化类型为sp3;[Al(OH)4]-中O和H之间为共价键,Al3+与OH-之间以配位键的形式结合,答案选BC;
(3)BN晶体硬,说明BN为原子晶体,B-N键能大,因此质地坚硬,其共价键具有方向性,受到外力时,会发生原子错位,因此脆;从晶胞构型中可看出,B原子形成8个正四面体,有4个N原子填充4个正四面体中,因此晶胞的正四面体的空隙填充率为50%;根据晶胞结构可知,每个晶胞中含有N原子数为4,B原子个数为![]() =4,晶胞的质量为
=4,晶胞的质量为![]() g,B、N间的距离是a nm,是体对角线的
g,B、N间的距离是a nm,是体对角线的![]() ,根据勾股定理,推出晶胞的边长为
,根据勾股定理,推出晶胞的边长为![]() nm,根据密度的定义,求出阿伏加德罗常数为
nm,根据密度的定义,求出阿伏加德罗常数为![]() 。
。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A. ![]() <1.0×10-7mol/L
<1.0×10-7mol/L
B. c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C. c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
D. c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
HF(aq)+OH—(aq)=F—(aq)+H2O(l)△H=—67.7 kJ·mol—1
②H+(aq)+OH—(aq)=H2O(l)△H=—57.3 kJ·mol—1
在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A. 氢氟酸的电离方程式及热效应可表示为HF(aq)=H+(aq) +F(aq) △H=+10.4kJ·mol—1
B. 当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C. 当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D. 当V>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单过硫酸氢钾复合盐(PMPS)的化学组成为![]() ,可用作饮用水消毒剂、养殖业中的供氧剂和烟气的脱硫脱硝剂等。某校设计实验制备PMPS并探究其件质。冋答下列问题:
,可用作饮用水消毒剂、养殖业中的供氧剂和烟气的脱硫脱硝剂等。某校设计实验制备PMPS并探究其件质。冋答下列问题:
(1)甲组同学制备PMPS溶液的步骤如下:
步骤1.将30%![]() 溶液用冰水冷却后,向其中缓慢滴加浓硫酸,得到
溶液用冰水冷却后,向其中缓慢滴加浓硫酸,得到![]() 和
和![]() 的混合溶液;
的混合溶液;
步骤2.加入![]() 作稳定剂,分批加入
作稳定剂,分批加入![]() ,至溶液pH为2~3时得到无色的PMPS溶液。
,至溶液pH为2~3时得到无色的PMPS溶液。
①“步骤1”![]() 溶液需事先用冰水冷却的目的是____________;加入浓硫酸发生反应(可逆反应)的化学方程式为____________。
溶液需事先用冰水冷却的目的是____________;加入浓硫酸发生反应(可逆反应)的化学方程式为____________。
②实验室中用pH试纸测定溶液pH的方法是____________。
(2)乙组同学取少量PMPS溶液加入试管中,向其中滴入2滴![]() 溶液,溶液变为紫色,说明氧化性:
溶液,溶液变为紫色,说明氧化性:![]() ____________
____________![]() (填“>”或“<”)。
(填“>”或“<”)。
(3)PMPS可用于刻蚀铜,丙组同学在PMPS溶液中加入适量的硫酸并加入铜箔,则发生的主要反应的化学方程式为________________。
(4)文献报道添加适量NaClO的PMPS可有效脱除烟气中的NO,某同学设计下列装置进行验证。
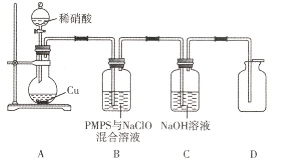
①装置A中发生反应的离子方程式为________________
②盛装稀硝酸的仪器名称是____________;装置C的作用是____________
③能说明D(气体无色)中几乎不含NO的现象是____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
①标准状况下,1LHCl和1LH2O的物质的量相同;
②常温常压下,1gH2和14gN2的体积相同;
③28gCO的体积为22.4L;
④两种物质的物质的量相同,则它们在标准状况下的体积也相同;
⑤同温同体积时,气体的物质的量越大,则压强越大;
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A. ①③④⑥B. ②⑤⑥C. ⑤⑥D. ①⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青金石是碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氧、氧等元素,曾用来制作颜料。
(1)在周期表中,与Si的化学性质最相似的邻族元素是_________。
(2) Na+和 Ne互为等电子体,电离能 I2(Na)_________I1(Ne)填"〉”或“<")。
(3)已知氯、硫有多种含氧酸,HClO4中共价键类型有_____,硫酸的结构式为_____。
(4)氢卤酸(HX)的电离过程如图。△H1和△H2的递变规律:HF > HCl> HBr >HI,其中△H1(HF)特别大的原因为________,影响△H2递变的因素为________。
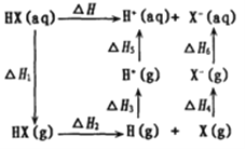
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物AH的转化关系如下图所示。其中A是植物生长调节剂,它的产量可以用来衡量一个国家的石油化工发展水平;D是一种合成高分子材料,此类物质如果大量使用易造成“白色污染”。
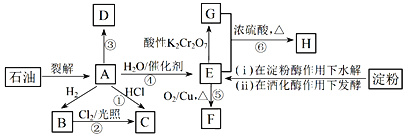
请回答下列问题:
(1)E官能团的电子式为_____。
(2)关于有机物A、B、C、D的下列说法,不正确的是____(选填序号)。
a. A、B、C、D均属于烃类
b. B的同系物中,当碳原子数≥4时开始出现同分异构现象
c. 等质量的A和D完全燃烧时消耗O2的量相等,生成CO2的量也相等
d. B不能使溴水或酸性高锰酸钾溶液褪色,但A和D可以
(3)写出下列反应的化学方程式:
反应③:____________________________;
反应⑥:_____________________________。
(4)C是一种速效局部冷冻麻醉剂,可由反应①或②制备,请指出用哪一个反应制备较好:_______,并说明理由:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(![]() )废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
)废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀经干燥后得到nmol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A. 消耗硫酸亚铁铵的物质的量为n(2-x)mol
B. 处理废水中![]() 的物质的量为
的物质的量为![]() mol
mol
C. 反应中发生转移的电子数为3nxmol
D. 在FeO· FeyCrxO3中,3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空题
(1)“金属钙线”是炼制优质钢材的脱氧脱磷剂,某“金属钙线”的主要成分为金属M和金属钙Ca,并含有3.5%(质量分数)CaO.
①Ca元素原子结构示意图________,Ca(OH)2碱性比Mg(OH)2______(填“强”或“弱”).
②配平用“金属钙线”脱氧脱磷的方程式:___P +____FeO +____CaO![]() ____Ca3(PO4)2 +____Fe
____Ca3(PO4)2 +____Fe
③将“金属钙线”试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色的M(OH)n,该颜色变化过程的化学方程式为:_____________________,实验室检测Mn+最常用的试剂是___________(填化学式)
④取3.2 g“金属钙线”试样,与水充分反应,生成448 mL H2(标准状况),在所得溶液中通入适量的CO2,最多能得到CaCO3________g,“金属钙线”试样中金属M的质量分数为______.
(2)氢化钙(CaH2)固体登山运动员常用的能源提供剂
①写出CaH2与水反应的化学方程式__________________,该反应的氧化产物是___.
②请你设计一个实验,用化学方法区分钙与氢化钙,写出实验简要步骤及观察到的现象_____.
③登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是_______________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com