
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀盐酸 | MnO2 | 石蕊溶液 | 石蕊溶液先变红后褪色 | |
| B | 浓硫酸 | 蔗糖 | 品红 | 浓硫酸有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | 生成BaSO3白色沉淀 | |
| D | 醋酸 | Na2CO3 | 苯酚钠溶液 | 酸性:醋酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化锰与浓盐酸反应制备氯气,需要加热;
B.浓硫酸具有脱水性,蔗糖碳化后与浓硫酸反应生成二氧化硫、二氧化碳,二氧化硫具有漂白性;
C.盐酸与亚硫酸钠反应生成二氧化硫,二氧化硫与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡沉淀;
D.醋酸易挥发,醋酸与苯酚钠反应,干扰二氧化碳与苯酚钠的反应.
解答 解:A.二氧化锰与浓盐酸反应制备氯气,需要加热,而稀盐酸、二氧化锰不反应,盐酸易挥发,石蕊变红,故A错误;
B.浓硫酸具有脱水性,蔗糖碳化后与浓硫酸反应生成二氧化硫、二氧化碳,二氧化硫具有漂白性,则品红褪色,实验能得出相应实验结论,故B正确;
C.盐酸与亚硫酸钠反应生成二氧化硫,二氧化硫与Ba(NO3)2溶液发生氧化还原反应生成硫酸钡沉淀,结论不合理,故C错误;
D.醋酸易挥发,醋酸与苯酚钠反应,干扰二氧化碳与苯酚钠的反应,则该实验不能比较碳酸、苯酚的酸性,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的制备实验、性质实验、实验装置的作用及实验结论等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
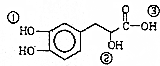
| A. | 该有机物的分子式为C9H10O5 | |
| B. | 该有机物能发生缩聚、加成、消去、氧化反应 | |
| C. | 1mol该有机物最多可以和4molNaOH发生反应 | |
| D. | 该有机物分子中①、②、③3个-OH的酸性由强到弱的顺序是③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+) | B. | c(H+)•c(OH-) | C. | $\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ | D. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键、氢键、共价键 | B. | 氢键、氢键、离子键 | ||
| C. | 氢键、共价键、分子间作用力 | D. | 分子间作用力、氢键、共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1LpH=11的氨水中含有阳离子总数为0.001NA | |
| B. | 4g${\;}_{1}^{2}$H2中所含的质子数为4NA | |
| C. | 1mol甲醇中含有C-H键的数目为4NA | |
| D. | 常温常压下,22.4L的NO2和CO2混合气体含有2NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油、煤、天然气、油脂都属于化石燃料 | |
| B. | 油脂在碱性条件下的水解反应又称为皂化反应 | |
| C. | 分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体 | |
| D. | 蔗糖是还原性糖,能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
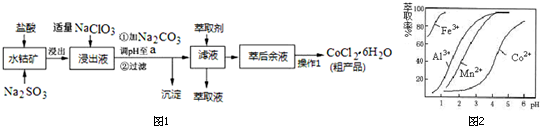
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
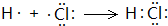 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com