
| A.合成纤维和光导纤维都是新型的无机非金属材料 |
| B.维生素C受热更易被氧化,故有些新鲜蔬菜生吃较好 |
| C.水晶、陶瓷、玻璃的主要成分都是硅酸盐 |
| D.蚕丝、羊毛和淀粉分别属于纤维素、蛋白质和多糖 |
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.热还原法、热分解法、电解法 | B.热分解法、热还原法、电解法 |
| C.电解法、热分解法、热还原法 | D.热分解法、电解法、热还原法 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
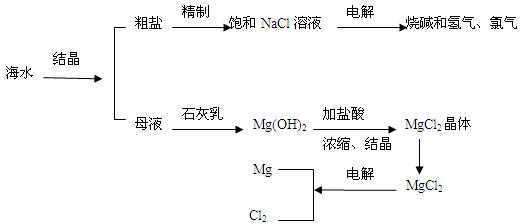
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
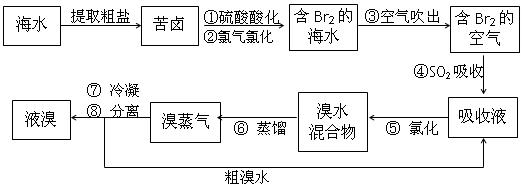

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加大开发太阳能、水能、风能、地热能等能源力度,减少化石燃料的使用 |
B.研制乙醇汽油技术 ,降低机动车辆尾气中有害气体排放 ,降低机动车辆尾气中有害气体排放 |
| C.生产、生活中,努力实现资源的循环利用 |
| D.利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.聚乙烯是天然高分子材 | B.所有的橡胶都是天然高分子材料 |
| C.钢化玻璃和玻璃钢是同种材料 | D.高分子分离膜是具有特殊分离功能的高分子材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
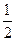 O2(g)===CO(g)+2H2(g);
O2(g)===CO(g)+2H2(g);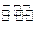 CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。
CH3OH(g);△H="-Q" kJ·mol-1(Q>O),达到平衡后的压强是开始时压强的0.6倍,放出热量Q1kJ。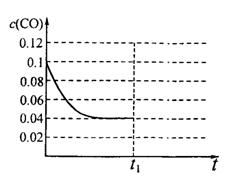
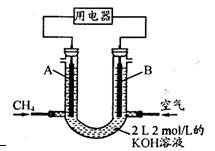
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com