
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期原子半径最小的元素。试回答以下问题:
(1)写出A与D以1∶1的原子个数比形成的化合物的电子式:______________。F的离子结构示意图为_______________________。
(2)B、D形成的化合物BD2中存在的化学键为________键(填“离子”或“共价”,下同)。A、D、E三种元素形成的化合物为____________化合物。
(3)化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为________________________________。
(4)化合物C2A4和C2D4的液体曾被用作火箭推进剂,燃烧反应的生成物是一种气态单质和一种化合物,它们对环境无污染。1 mol C2A4液体和足量C2D4液体完全反应生成两种气体时放出热量516.8 kJ,则该反应的热化学方程式为_________________________________。
【答案】![]()
![]() )共价 离子 OH-+HCO3-=CO32-+H2O 2N2H4(l)+N2O4(l) ═3N2(g)+4H2O(g) ΔH= -1033.6kJ·mol–1
)共价 离子 OH-+HCO3-=CO32-+H2O 2N2H4(l)+N2O4(l) ═3N2(g)+4H2O(g) ΔH= -1033.6kJ·mol–1
【解析】
短周期主族元素A、B、C、D、E、F的原子序数依次增大,由B形成的化合物种类繁多,可以知道B为C元素;根据C、D为空气中含量最多的两种元素,且C、D的原子序数依次增大,所以C为N元素,D为O元素;D、E形成两种不同的离子化合物,则E为Na;F为同周期半径最小的元素,E、F同周期,所以F为Cl元素;它们的原子核外电子层数之和为13,A的电子层数为13-2-2-2-3-3=1,则A为H元素;以此分析解答。
(1)由上述分析可知:A为H元素,D为O元素,所以A与D以1∶1的原子个数比形成的化合物为H2O2,其电子式:![]() 。由F为Cl元素,所以F的离子结构示意图为
。由F为Cl元素,所以F的离子结构示意图为![]() ;所以本题答案:
;所以本题答案:![]() ;
; ![]() ;
;
(2)由上述分析可知;B为C元素,D为O元素,B、D形成的化合物为CO2属于共价化合物,分子中存在共价键。由A为H元素,D为O元素,E为Na,A、D、E三种元素形成的化合物为氢氧化钠,属于离子化合物。所以本题答案:共价;离子;
(3)由A为H元素,B为C元素,D为O元素,E为Na,化合物甲、乙由A、B、D、E中的三种或四种组成,且甲、乙的水溶液均呈碱性。所以甲、乙可能为Na 2CO3、NaOH、NaHCO3中的两种,且甲、乙两种物质能反应,所以甲、乙中一个为NaOH,一个为NaHCO3,两者反应的离子方程式为OH-+HCO3-=CO32-+H2O;答案:OH-+HCO3-=CO32-+H2O。
(4)由C为N元素,A为H元素,D为O元素,所以化合物C2A4为N2H4,C2D4的化学式为N2O4, 1mol C2A4液体和足量C2D4液体完全反应生成两种气体时放出热量516.8 kJ,所以该反应的热化学方程式为2N2H4(l)+N2O4(l) ═3N2(g)+4H2O(g) ΔH= -1033.6kJ·mol–1,答案:2N2H4(l)+N2O4(l) ═3N2(g)+4H2O(g) ΔH= -1033.6kJ·mol–1


科目:高中化学 来源: 题型:
【题目】在生产生活中,我们会遇到各种各样的化学反应。请按要求完成相应的化学方程式(是离子反应的用离子方程式表示):
(1)金属镁在二氧化碳中燃烧的化学方程式: _____________________________
(2)氯化铵是一种常用化肥,与强碱(NaOH)加热(离子方程式)___________________。
(3)工业上以氯气和石灰乳为原料制造漂白粉____________________________________________。
(4)用FeCl3 溶液与铜反应制作印刷电路板离子方程式__________________________。
(5)碳与二氧化硅在高温条件下反应___________________________________。
(6)工业上电解饱和食盐水制取氯气的离子方程式为_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥法表示下列反应的电子转移情况并将其改写成离子方程式:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,________________________,离子方程式为________________________。当3.84gCu被氧化时,__________gHNO3被还原,产生标准状况下的气体________L,转移电子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:CS2(l)+3O2(g)=CO2(g) +2SO2(g) ,现有0.228g CS2液体在448mL氧气(标准状况,过量)中充分燃烧,恢复至标准状况后所得气体为
A.112 mLB.224 mLC.336 mLD.448 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2O2的电子式____________________
(2)写出“海洋元素”的元素符号__________,该元素单质的苯溶液颜色为______________。
(3)写出木炭与浓硫酸共热时发生的化学反应方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸二甲酯(CO(OCH3))是一种无毒、环保性能优异、用途广泛的化工原料。在催化剂作用下,可由甲醇和CO2直接合成:CO2+2CH3OH→CO(OCH3)2+H2O。某研究小组在某温度下,在0.1L恒容密闭容器中投入2.5molCH3OH(g)、适量CO2和6×10-5mol催化剂,研究反应时间对甲醇转化数(TON)的影响,其变化曲线如图所示。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。下列说法不正确的是
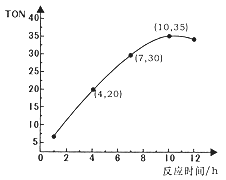
A. 在该温度下,最佳反应时间是10h
B. 4~10h内碳酸二甲酯的平均反应速率是7.5×10-4mol·L-1·h-1
C. 向反应体系中添加催化剂,一定能提高反应的TON
D. 该合成方法可以利用廉价的甲醇把影响环境的温室气体CO2转化为资源,在资源循环利用和环境保护方面具有重要意义
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料与生产、生活和科技密切相关。回答下列问题:
(1)无机非金属材料与我们的生活联系密切。我国具有独立知识产权的电脑芯片“龙芯一号”填补了我国计算机史上空白,“龙芯一号”材料的化学式为______;传统的无机非金属材料在日常生活中有着广泛的运用。玻璃和水泥的生产中均用到的原料的名称是____,其中碳酸钠在玻璃熔炉中反应的化学方程式为____________。
(2)金属材料的应用更是广泛。工业常用30%FeCl3溶液腐蚀绝缘板上铜箔,制造印刷电路板。腐蚀废液中含有Fe3+、Fe2+、Cu2+离子。当向腐蚀液中加入足量的Fe粉,一定不存在的离子是________;用实验判定腐蚀液中含有Fe2+离子______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了防止氮氧化物对空气的污染,人们采取了很多措施。
(1)如用CH4催化还原NO2可以消除氮氧化物的污染,发生的反应如下: CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1。
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ·mol-1。
①下列有关说法正确的是_________。
A.在容器中充入1mol CH4和2 mol NO2,当体系中n(CH4)/n(NO2)比值不随时间变化时,反应达到平衡状态
B.恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
C.体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量增大
D.恒温恒压时,充入CH4有利于提高氮氧化物的转化率
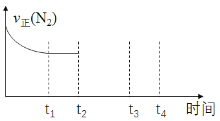
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态。请在右图中补充画出从t2到t4时刻v正(N2) 随时间的变化曲线:____________
(2)现有的汽车尾气处理的原理是:NO(g)+2CO(g)![]() N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________。
N2(g) +2CO2(g),通常使含适当比例的NO、CO尾气通过装有高效催化剂的处理装置。请根据以下相关数据,分析仅使用催化剂能否有效消除NO、CO尾气污染___________。
反应 | 25℃时的平衡常数 | 焓变 |
反应I:2NO(g) | K1=1×1030 | △H=-180.5kJ/mol |
反应II:2CO2 (g) | K2=4×10-92 | △H= +566.0kJ/mol |
(3)用NH3催化还原NOx也可以消除氮氧化物的污染,其反应原理为:NO(g) +NO2(g)+2NH3(g)![]() 2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=________________。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如p(NO2)为NO2的平衡分压,p(NO2)=x(NO2)p,p为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
2N2(g) + 3H2O(g)。一定温度下,在某恒定压强为P的密闭容器中充入一定量的NO、NO2和NH3,达到平衡状态后,容器中含n(NO)=a mol,n(NO2)=2a mol,n(NH3)=2a mol,n(N2)=2b mol,且N2(g)的体积分数为1/3,请计算此时的平衡常数Kp=________________。(用只含P的式子表示,且化至最简式)。(备注:对于有气体参加的反应,可用某组分的平衡分压代替物质的量浓度计算平衡常数,记作KP。如p(NO2)为NO2的平衡分压,p(NO2)=x(NO2)p,p为平衡总压,x(NO2)为平衡体系中NO2的物质的量分数。)
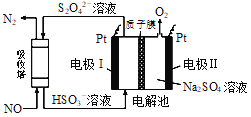
(4)用间接电化学法对大气污染物NO进行无害化处理,其原理示意如图(质子膜允许H+和H2O通过),电极I发生的电极反应为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是( )

A. 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响
C. 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高
D. 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com