
分析 化学反应中,化学键断裂吸收能量,形成新化学键放出能量,根据方程式计算,反应热与化学计量数成正比,以此计算1mol N2(g)和3mol H2(g)完全转化为NH3(g)的反应热.
解答 解:拆1molH-H键、1molN≡N、1molN-H键分别需要吸收的能量为436kJ、946kJ、391kJ,在反应N2+3H2?2NH3中,断裂3mol H-H键,1mol N三N键共吸收的能量为:3×436kJ+946kJ=2254kJ,
生成2mol NH3,共形成6molN-H键,放出的能量为:6×391kJ=2346kJ,
吸收的能量少,放出的能量多,该反应为放热反应,
放出的热量为:2346kJ-2254kJ=92kJ,1mol N2(g)和3mol H2(g)完全转化为NH3(g)生成2mol NH3放出热量为92KJ,
故答案为:放出92KJ热量.
点评 本题考查反应热的计算,为高频考点,侧重于学生的分析能量和计算能力的考查,题目难度不大,注意把握从键能的角度计算反应热的方法.


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 夜里的月色本身就很美 | |
| B. | 空气中的小水滴颗粒直径约为1nm-100nm | |
| C. | 光线是一种胶体 | |
| D. | 雾是一种胶体,能产生丁达尔现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
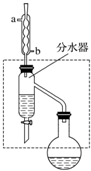 乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
乙酸丁酯是重要的化工原料,具有水果香味.实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:| 乙酸 | 正丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.0 |
| 密度/g•cm-3 | 1.1 | 0.80 | 0.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
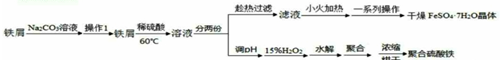
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
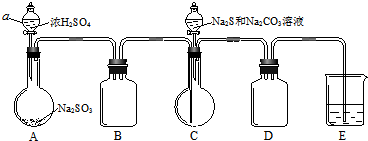
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
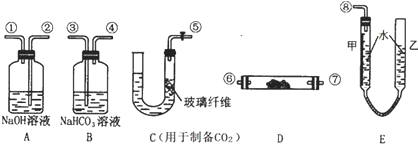
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 v(NH3)=5v(O2) | B. | 5v(O2)=6v(H2O) | C. | 4v(NH3)=6 v(H2O) | D. | 4v(O2)=5 v(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com