
金属锌为活泼金属,易被腐蚀。下列关于锌的腐蚀说法正确的是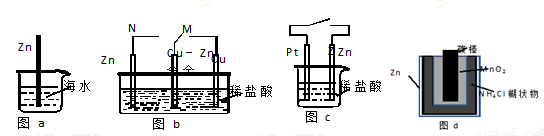
A.图a中,??入海水中的锌棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由Zn的氧化作用引起的
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:简答题
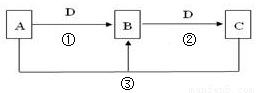
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是 ,工业上制取A的离子方程式Ⅰ为 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。
(3)若D是氯碱工业的主要产品,B有两性,则反应②的离子方程式是 。
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式 ;
(5)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上.在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
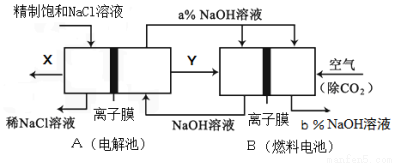
(6)Ⅰ①图中X、Y分别是 (填化学式),分析比较图示中氢氧化钠质量分数a% b%(填“>”、“=”或“<”)
②写出燃料电池B中负极上发生的电极反应 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:推断题
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、炭粉、氧化铁等涂覆在铝箔上制成.由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收研究,并设计出相关实验流程图
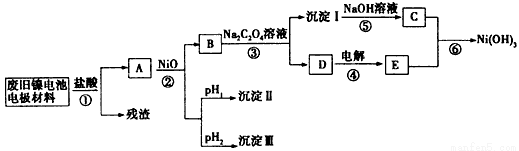
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如表所示:

回答下列问题:
(1)根据表数据判断步骤②依次析出沉淀Ⅱ 和沉淀Ⅲ (填化学式),则pH1 pH2(填填“>”、“=”或“<”),控制两种沉淀析出可利用 。
A.pH试纸 B.石蕊指示剂 C.pH计
(2)已知溶解度:NiC2O4>NiC2O4?H2O>NiC2O4?2H2O,则反应③的化学方程式是 。第③步反应后,过滤沉淀时需要的玻璃仪器有 。若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因 、 。
(3)④中阳极反应产生的气体E为 ,验证该气体的试剂为 。
(4)试写出反应⑥的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列叙述正确的是
A.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极区产生的Cl2进入阳极区
B.电解精炼铜时,反应开始一段时间内阳极溶解铜的质量比阴极析出铜的质量大
C.海轮外壳上镶入锌块,可减缓船体的腐蚀
D.在铁片上镀铜时,若铁片增重3.2g,则电路中通过的电子的物质的量为0.05mol
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:简答题
已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有7个电子.
请回答下列问题:
(1)G基态原子的核外电子排布式是 ;
(2)C、D、E的第一电离能由大到小的顺序是:
(3)下列有关上述元素的说法中,不正确的是 (填字母)
a.B单质的熔点在同族单质中最高
b.1mol A 2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含 个σ键。
(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为 ;
(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“?”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为 。
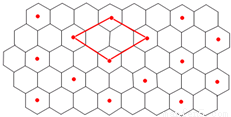
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
下列说法不正确的是
A.镁铝合金的熔点低于铝的熔点
B.把稀H2SO4加入NaAlO2溶液中生成白色沉淀然后沉淀又溶解
C.NaOH溶液不能长时间在分液漏斗中放置
D.蘸有浓硫酸的玻璃棒接近浓氨水瓶口有白烟产生
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:简答题
无水AlCl3易升华,可用作有机合成的催化剂等,工业上由铝土矿(主要成分是Al2O3和Fe2O3,还含有少量的SiO2 )和石油焦(主要成分是C)为原料制备无水AlCl3:2Al2O3+6Cl2===4AlCl3+3O2
回答以下问题:
(1)Cl-的电子式为 ________。Al在元素周期表最中的位置是________。
(2)生产中加入石油焦,其目的是_____________________________________。
(3)加入焦炭后的化学反应可表示为Al2O3+C+Cl2 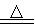 AlCl3+X↑,设计实验确定气体X的成分:
AlCl3+X↑,设计实验确定气体X的成分:
____________________________________________________________。
(4)在提纯AlCl3粗产品时,需加入少量铝粉,可使熔点较低的FeCl3转化为熔点较高的FeCl2,从而避免在AlCl3中混入铁的氯化物。该反应的化学方程式为 _____________________________________________________________。
(5)为测定制得的无水AlCl3产品(含FeCl3杂质)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①过程涉及的离子方程式__________________________、___________。
②AlCl3产品的纯度为__________________________________。
(6)以铝土矿为原料可以通过以下途径提纯氧化铝

①写出滤液甲中溶质的化学式______________________________。
②写出滤液乙中加入过量氨水得到Al(OH)3的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合2 题型:简答题
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤,已知
SO2(g)+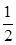 O2(g)
O2(g) SO3(g)△H=-98 kJ·mol-1。
SO3(g)△H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=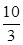 ,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol
SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v正 v逆(填“<”、“>”或“=”)。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 molO2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为 。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
A保持温度和容器体积 不变,充入1.0 mol O2
不变,充入1.0 mol O2
B保持温度和容器内压强不变,充入1.0 mol SO3
C降低 温度
温度
D移动活塞压缩气体
(4)若以右图所示装置,用电化学原理生产硫酸,写出通入O2电极的电极反应式为 。
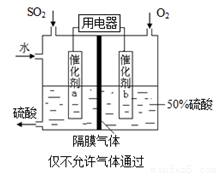
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为 。
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和下表中提供的物质完成相关实验,合理的选项是
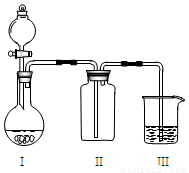
选项 | I中的物质 | II中收集的气体 | III中的物质 |
A | Cu和浓硝酸 | NO | NaOH溶液 |
B | 浓盐酸和MnO2 | Cl2 | NaOH溶液 |
C | 碳酸钙和盐酸 | CO2 | 澄清石灰水 |
D | 浓氨水和CaO | NH3 | 酚酞溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com