
【题目】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
【答案】A
【解析】
试题分析:A.酸的电离平衡常数越大,酸的酸性越强,根据电离平衡常数知,酸性HCOOH>H2CO3>HCN>HCO3-,结合强酸制取弱酸知,该反应方程式为CN-+H2O+CO2=HCN+HCO3-,A错误;B.HCN为弱酸,NaCN溶液水解溶液显显碱性;HCN的Ka=6.17×10-10,根据其水解方程式CN-+H2O![]() HCN+OH-,得水解平衡常数Kh=Kw/Ka=1014/5.0×1010=2×10-5=c(OH)·c(HCN)/c(CN)=105×c(HCN)/c(CN),所以c(CN-)<c(HCN),C正确;C.等pH的HCOOH和HCN,c(HCOOH)<c(HCN),等体积等pH的醋酸和HCN,HCN的物质的量多,中和等pH、等体积的醋酸和HCN溶液,消耗的n(NaOH)与酸的物质的量成正比,所以HCN消耗的NaOH多,C正确;D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子总数多,D正确;答案选A。
HCN+OH-,得水解平衡常数Kh=Kw/Ka=1014/5.0×1010=2×10-5=c(OH)·c(HCN)/c(CN)=105×c(HCN)/c(CN),所以c(CN-)<c(HCN),C正确;C.等pH的HCOOH和HCN,c(HCOOH)<c(HCN),等体积等pH的醋酸和HCN,HCN的物质的量多,中和等pH、等体积的醋酸和HCN溶液,消耗的n(NaOH)与酸的物质的量成正比,所以HCN消耗的NaOH多,C正确;D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子总数多,D正确;答案选A。


科目:高中化学 来源: 题型:
【题目】下列有关实验的说法不正确的是( )
A.容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶都无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗
B.在4 mL0.1 mol/L的K2Cr2O7溶液中滴加数滴1 mol/L的NaOH溶液,溶液颜色从橙色变成黄色
C.探究化学反应的限度:取5 mL 0.1 mol/LKI溶液,滴加0.1 mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应
D.将含有少量氯化钾的硝酸钾放入烧杯中,加水溶解并加热、搅拌,当溶液表面出现一层晶膜时停止加热,冷却结晶、过滤即可得到大量硝酸钾晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.8g碳置于2.24L(标准状况)O2中充分燃烧,至全部反应物耗尽,测得放出热量30.65kJ,已知:C(s)+O2(g)=CO2(g)△H=﹣393.0kJmol-1综合上述信息,请写出CO完全燃烧的热化学方程式__________________________。
(2)光气(COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)![]() COCl2(g)△H<0制备。如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线(图中Cl2的起始浓度为1.2mol/L,CO的起始浓度为1.0mol/L)。回答下列问题:
COCl2(g)△H<0制备。如图1为某次模拟实验研究过程中容积为1L的密闭容器内各物质的浓度随时间变化的曲线(图中Cl2的起始浓度为1.2mol/L,CO的起始浓度为1.0mol/L)。回答下列问题:

①若保持温度不变,在第8min加入体系中的三种物质个1mol,则平衡____________移动(填“向反应正方向”、“向逆反应方向”或“不”);
②若将初始投料浓度变为c(Cl2)=0.8mol/L、c(CO)=0.6mol/L、c(COCl2)=____________mol/L,保持反应温度不变则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
③比较第8秒反应温度T(8)与第15min反应温度T(15)的高低:T(8) T(15)(填“<”、“>”、或“=”)
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
①已知一定条件下,该反应中CO2的平衡转化率随温度、投料比 [![]() ]的变化曲线如图2:在其他条件不变时,请在图3中画出平衡时CH3OCH3的体积分数随投料比[
]的变化曲线如图2:在其他条件不变时,请在图3中画出平衡时CH3OCH3的体积分数随投料比[![]() ]变化的曲线图:
]变化的曲线图:

(4)常温下,将 a mol·L -1的醋酸 与 b mol·L -1 Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在 2c(Ba 2+)=c(CH3COO-),则混合溶液中醋酸的电离常数 Ka=______________(含a和b的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )

A.NaCl的物质的量为0.1mol
B.该混合液中BaCl2的物质的量为0.05mol
C.溶质MgCl2的质量为9.5 g
D.将该混合液加水稀释至体积为1 L,稀释后溶液中的Na+物质的量的浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A.Cl2是氧化剂,NaOH是还原剂
B.被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2既做氧化剂又做还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O。下列说法不正确的是
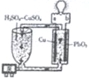
A.a为负极,b为正极
B.该电池工作时PbO2电极附近溶液的pH增大
C.a极的电极反应为Cu-2e-=Cu2+
D.调节电解质溶液的方法是补充CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图电化学原理可用于治理水中硝酸盐的污染,下列说法不正确的是
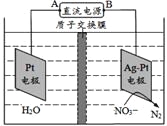
A. A为电源正极
B. 在Pt电极上发生氧化反应
C. 阴极电极反应式为NO3-+6H2O+10e-==N2+12OH
D. 若电路转移10mol电子质子交换膜右侧溶液质量减少18g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g)![]() H2(g)+CO2(g) △H﹤0,在其他条件不变的情况下,下列说法正确的是
H2(g)+CO2(g) △H﹤0,在其他条件不变的情况下,下列说法正确的是
A.加入催化剂,改变了反应的途径,反应的△H也随之改变
B.改变压强(压缩气体或扩大容积),平衡不发生移动,反应放出的热量不变
C.升高温度,反应速率加快,反应放出的热量不变
D.若在原电池中进行,反应放出的热量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)![]() 2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是
2C(g) ΔH < 0。t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图。下列说法正确的是

A.0~t2时,v正始终大于v逆
B.Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ
C.Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ
D.t2时刻改变的条件可以是向密闭容器中加C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com