
 计算物质的量;
计算物质的量; 计算物质的量;
计算物质的量;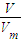 计算物质的量,
计算物质的量, =
= =5mol,故答案为:5;
=5mol,故答案为:5; =
= 4mol,故答案为:4;
4mol,故答案为:4; =
= =3mol,故答案为:3;
=3mol,故答案为:3;

科目:高中化学 来源:河北省张家口沽源一中2012届高三高考预测化学试题 题型:022
钠及其化合物具有广泛的用途.
(1)工业上可利用反应Na(1)+KCl(1)![]() K(g)+NaCl(1)来治炼金属钾,此反应利用了钠的还原性及________,写出钠与TiCl4反应冶炼Ti的化学方程式________.
K(g)+NaCl(1)来治炼金属钾,此反应利用了钠的还原性及________,写出钠与TiCl4反应冶炼Ti的化学方程式________.
(2)用Na2CO3熔融盐作电解质,CO、O2为原料组成的新型电池的研究取得了重大突破.该电池示意图如下:

负极电极反应式为________,为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环.A物质的化学式为________.
(3)常温下,浓度均为0.1 mol·L-1的下列五种钠盐溶液的pH如下表;
上述盐溶液中的阴离子,结合H+能力最强的是________,根据表中数据,浓度均为0.01 mol·L-1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号).
A.HCN
B.HClO
C.CH3COOH
D.H2CO3
(4)实验室中常用NaOH来进行洗气和提纯.当300 mL 1 mol·L-1的NaOH溶液吸收标准状况下4.48 LCO2时,所得溶液中各离子浓度由大到小的顺序为________.
几种离子开始沉淀时的pH如下表:
![]()
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,________(填离子符号)先沉淀,Ksp[(Fe(OH)2)]________Ksp[(Mg(OH))2](填“>”、“=”或“<”).
查看答案和解析>>
科目:高中化学 来源:2010年江苏省南京市金陵中学高三上学期期中考试化学试题 题型:实验题
(18分)金属钛素有“太空金属”、“海洋金属”、“未来金属”等美誉,我国有丰富的钛矿资源。
(1)钛冶炼的旧法是用金属钠热还原四氯化钛。
请回答下列问题:
①试推测,在金属系列中,钛属于 (填“较活泼”或“较不活泼”)的金属。金属钛耐腐蚀可能原因是 。
②TiC14 工业上是用过量焦炭、氯气与TiO2在高温下反应制得的,该反应的化学方程式为 。
(2)已知化合态的钛:有+4价和+3价,其中+3价极易被氧化。有关氢氧化物开始沉淀的pH如表l
表l 有关氢氧化物开始沉淀的pH
| 氢氧化物 | Ti(OH)4 | Ti(OH)3 | Fe(OH)3 | Fe(OH)2 |
| pH | 0.5 | 3.0 | 1.5 | 7.6 |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com