
【题目】为了将混有硫酸钠、碳酸氢铵的氯化钠提纯,并制得纯净的氯化钠溶液,某学生设计如下实验:

![]()
![]()
![]()
![]()

![]()
![]()
![]()

![]()
请回答下列问题:
(1)操作②________(填“能”或“不能”)用硝酸钡溶液,说明理由:_______________。
(2)进行操作②后,判断SO![]() 已除尽的方法是____________________。
已除尽的方法是____________________。
(3)操作③的目的是________;不先过滤就滴加碳酸钠溶液,其理由是_________。
(4)此设计方案是否严密?______(填“是”或“否”),说明理由______。
【答案】 不能 硝酸根离子会成为新的杂质,且很难除去 将滴加BaCl2溶液后的溶液静置,取少许上层清液,滴加BaCl2溶液,若无浑浊,则SO![]() 已除尽 除去过量的Ba2+ 加入的Na2CO3溶液不会使已生成的沉淀溶解,且一次过滤可以节约药品和时间 否 为了除去多余的Ba2+,加入的Na2CO3必须过量,过量的CO
已除尽 除去过量的Ba2+ 加入的Na2CO3溶液不会使已生成的沉淀溶解,且一次过滤可以节约药品和时间 否 为了除去多余的Ba2+,加入的Na2CO3必须过量,过量的CO![]() 成为新的杂质,应该再加适量的盐酸将其除去
成为新的杂质,应该再加适量的盐酸将其除去
【解析】(1)加入硝酸钠溶液,硝酸钠和硫酸钠反应生成硫酸钡和硝酸钠,除去了硫酸钠,但引入了硝酸钠等新的杂质,故答案为:不能,硝酸根离子会成为新的杂质,且很难除去;
(2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,故答案为:取少量上层澄清溶液,再滴加BaCl2溶液,如无沉淀出现则说明SO42-已除尽;
(3)操作③加入碳酸钠溶液,碳酸钠与过量的氯化钡反应生成碳酸钡和氯化钠,除去过量的氯化钡,再过滤;先过滤而后加碳酸钠溶液,在加入碳酸钠溶液后生成的碳酸钡还需要过滤,因此一次性过滤掉BaSO4沉淀和BaCO3沉淀,可以节约药品和时间,故答案为:除去过量的Ba2+;加入的Na2CO3溶液不会使已生成的沉淀溶解,且一次过滤可以节约药品和时间;
(4)此方案不严密,过量的碳酸钠没有除去,得到的溶液中含有氯化钠和过量的碳酸钠两种溶质,致使得到的氯化钠溶液不纯,应在操作④之后加入适量盐酸除去碳酸钠,然后再加热煮沸除去HCl,故答案为:否;为了除去多余的Ba2+,加入的Na2CO3必须过量,过量的CO![]() 成为新的杂质,应该再加适量的盐酸将其除去。
成为新的杂质,应该再加适量的盐酸将其除去。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】将a g由CO和H2组成的混合气体在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为
A. a g B. ![]() g
g
C. ![]() g D.
g D. ![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案。已知:NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O

如果此方案正确,那么:
(1)操作①可选择_________仪器。A、烧瓶B、烧杯C、锥形瓶D、坩埚E、蒸发皿
(2)操作②是否可改为加硝酸钡溶液?为什么?________(填能或不能)理由_________________。
(3)操作③的目的是_________________________________;为什么不先过滤后加碳酸钠溶液?理由是___________________。
(4)加入盐酸的目的_______________(用化学方程式表示)。
(5)操作④的目的是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等。某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案:
海水 滤液
滤液 滤液
滤液 NaCl溶液
NaCl溶液![]() NaCl
NaCl
(1)步骤Ⅰ中试剂A为________,加入过量A的目的是________。
(2)步骤Ⅱ中试剂B为________,加入过量B的目的是________。
(3)步骤Ⅲ中试剂C为_____,加入过量C至______,其目的是________。
(4)步骤Ⅳ的实验操作为________,试根据图示回答:

①按顺序写出图中编号仪器的名称:_________________________;
②仪器a的作用是________,其目的是_________________________。
③当仪器b中出现________时即可停止加热。
(5)该化学兴趣小组用分离得到的氯化钠配制100 mL 1 mol/L的NaCl溶液,配制过程中需用托盘天平称取精盐的质量为______g,用于定容的玻璃仪器的规格和名称是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置关系如图所示,下列说法不正确的是

A. 若它们均为金属元素,则Y的氧化物可能含有共价键
B. 若Z的核电荷数是X的2倍,则ZX2为大气污染物
C. 若Y的最外层电子数等于其周期序数,则Z可为半导体材料
D. 若X、Z均为非金属元素,则形成酸的酸性X一定强于Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方法不正确的是
A.用铜丝燃烧法法可定性确定有机物中是否存在卤素
B.做过碘升华实验的试管可先用酒精清洗,再用水清洗
C.可用去锈细铁丝或铂丝进行焰色反应实验
D.红外光谱仪可用来确定物质中含有哪些金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
物质 | 乙酸 | 正丁醇 | 乙酸丁酯 |
熔点/ ℃ | 16.6 | -89.5 | -73.5 |
沸点/ ℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
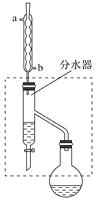
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)管口通入;通过分水器下端旋塞分出的生成物是________,其目的是_____________________________。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________(填标号)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
②分液漏斗有两种,如下图。分液时应选择下图中________形分液漏斗,其原因是_____________________________________________。

③蒸馏操作时,需收集________ ℃的馏分,沸点大于140 ℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是( )
A. SO2可用于漂白纸浆 B. SiO2是良好的半导体材料
C. 硅单质可用来制造太阳能电池 D. Cl2可用于消毒和制造漂白粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com