
��13�֣���A��B��C��D��E��R���ֶ�����Ԫ�أ���Ԫ��������Ϣ���±���
| Ԫ�ر�� | Ԫ��������Ϣ |
| A | �䵥�����ܶ���С������ |
| B | �������Ӵ�������λ�ĸ���ɣ������ǿ�����Ҫ�ɷ�֮һ |
| C | ����������B�������Ӿ�����ͬ�ĵ��Ӳ�ṹ����ԭ�ӵ������������Ǵ�����1/4 |
| D | ����������������ﶼ�����ԣ�����Cͬ���� |
| E | ��Cͬ���ڣ���ԭ�Ӱ뾶�ڸ�������С |
| R | �ж��ֻ��ϼۣ����������Ϊ+6�� |
��1��þ ��  ��2�� O2����Mg2+��Al3+ ��HClO4
��2�� O2����Mg2+��Al3+ ��HClO4
��3���������������������зֱ��������NaOH��Һ�����ᣬ���嶼�ܹ��ܽ⡣ ��4��AD ��
��5��Mg��2H��=Mg2����H2������2Al+6H+��2 Al3++3H2������3Mg+2Al3+=3Mg2++2Al��
Cl2��S2��=S����2Cl������Cl2��H2S=S����2Cl����2H����
������������������������֪�⼸��Ԫ�طֱ��ǣ�A��H��B��O��C��Mg��D��Al; E��Cl��R��S����1��CԪ�ص�������þ��EԪ�ص�����Ϊ�ȣ���2��O��Mg��Al�����ӵĵ��Ӳ�ṹ��ͬ������2��8���Ų������ڵ��Ӳ�ṹ��ͬ������˵�����ӵĺ˵����Խ�����ӵİ뾶��ԽС�����Լ����Ӱ뾶�ɴ�С��˳����O2����Mg2+��Al3+��ClԪ�ص�ԭ���������7�����ӣ�����ϼ�Ϊ+7�ۣ���������ۺ�����Ļ�ѧʽ��HClO4����3��֤��Al(OH)3�������ԵIJ�����������Al(OH)3�зֱ��������NaOH��Һ�����ᣬ���嶼�ܹ��ܽ⡣�Ϳ�֤������4��A�� S�ĺ�������Ų���2��8��6�����Ԫ��Rλ�����ڱ��е�3 ���ڣ���A�塣��ȷ��B��S2����Arԭ�ӵ��Ӳ�ṹ��ͬ������C��SO32�����еķ�Ӧ�о��������ԣ����еķ�Ӧ�б��ֻ�ԭ�ԡ�����D������������ԭ��Ӧ�еĵ���ת����Ŀ��ȿ�֪�ڷ�ӦRO32����2R2����6H�� = 3R��3H2O�У�ÿ����1 mol RO32�� ��ת�Ƶĵ��ӵ����ʵ���Ϊ4 mol����ȷ����5�����������������Ӧ�����ӷ���ʽ��Mg��2H��=Mg2����H2����Cl2��S2��=S����2Cl���ȡ�
���㣺����Ԫ�ص��ƶϡ����Ӱ뾶�Ĵ�С�Ƚϡ��������ʡ�����ת�ơ����ӷ���ʽ����д��֪ʶ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
A��B��C��D��E��F��Ԫ�����ڱ�ǰ�����ڵ�����Ԫ�أ�ԭ���������������������Ϣ���±���
| Ԫ�� | �����Ϣ |
| A | ԭ�ӵĺ���������͵��Ӳ������ |
| B | ��̬ԭ�Ӽ۵����Ų�Ϊnsnnpn |
| C | ��̬�⻯��������������ˮ���ﷴӦ������ |
| D | ��̬ԭ�ӵ����Ų���2��δ�ɶԵ��� |
| E | λ�ڵ������ڣ���ͬ������ԭ�Ӱ뾶��� |
| F | ��B �γɵĺϽ�ΪĿǰ�������Ľ������� |
 2CA3��H��0����Ӧ10min�ﵽƽ�⣬����0.2molCA3��
2CA3��H��0����Ӧ10min�ﵽƽ�⣬����0.2molCA3���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�10������
��ԭ��__ ___�� ����___________________________
�� ������______________________�� ������_________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
(12��)��������ijЩ������Ԫ����Ԫ�����ʻش����⡣
| �� | �� | �� | �� | �� | �� | �� | �� | �� | �� | �� |
| ԭ�Ӱ뾶/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
| ���̬ | +1 | +1 | �� | +3 | +4 | +5 | +7 | +1 | +5 | �� |
| ��ͼ�̬ | -1 | �� | -2 | �� | -4 | -3 | -1 | �� | -3 | -1 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��ɫ�п�ѧ�Ҵ��ᰣ����л���������֡����塱������2011��ŵ������ѧ���Լ��������ڣ��������ںܶ�Ӧ������չȭ�š������������첻ճ������������ܡ��ȵ�ת���豸�ȡ�
��1���������ڱ��е�λ�� ������ԭ�ӽṹʾ��ͼΪ ��
��2����ҵ�����õ�ԭ���� ����Al2O3��AlCl3����������һ�ֵ�ԭ����
��
��3��ͭ�ڳ�ʪ�Ŀ����л�����ͭ�̣�д���÷�Ӧ����ʽ
��
��4���õ�ⷨ��Fe(OH)2���������п����������Һ����
| A������ˮ | B��NaCl��Һ | C��NaOH��Һ | D��CuCl2��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
�����ʽṹ�����ʡ�
��֪A��B��C��D��E����Ԫ�����ڱ���ǰ36�ŵ�Ԫ�أ����ǵ�ԭ��������������Aԭ�ӻ�̬ʱ���������������ڲ����������2����Bԭ�ӻ�̬ʱs��������P��������ȣ�C��Ԫ�����ڱ��ĸ�Ԫ���е縺�����D�Ļ�̬ԭ�Ӻ�����6���ܼ���ȫ���������ӣ�Eԭ�ӻ�̬ʱδ�ɶԵ�������ͬ����Ԫ�������ġ�
��1����̬Eԭ�ӵļ۵����Ų�ʽΪ ��
��2��AB32-�����幹���� ������Aԭ�ӵ��ӻ���������� ��
��3��A22-��B22+��Ϊ�ȵ����壬B22+�ĵ���ʽ�ɱ�ʾΪ ��1mol B22+�к��еĦм���ĿΪ ��
��4���������ʾʽд��C���⻯��ˮ��Һ�д��ڵ�������� ��
��5��������DC2�ľ����ṹ��ͼ��ʾ�������ӻ���Э������ܶ�Ϊa g/cm3����������� ��ֻҪ������ʽ�������ӵ�������ֵΪNA��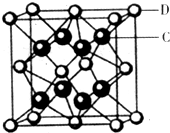
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ʴ���
��14�֣�A��B��C��D��E��F��ԭ������������������ֶ�����Ԫ�ء�F�ĵ�����D2��ȼ�յIJ����ʹƷ����Һ��ɫ��B�ĵ�����D2��ȼ�տ�����BD��BD2�������壻E��ԭ������ΪB��������AԪ�ص�һ�ֺ����в������ӡ���ش��������⣺
��1��C�ĵ��ʷ��ӵĽṹʽΪ ��ED�ĵ���ʽΪ ��
��2��E������BD2�о���ȼ�����ɺڰ����ֹ��壬�÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3��FD2����ͨ��BaCl2��HNO3�Ļ����Һ�У����ɰ�ɫ��������ɫ����CD���йط�Ӧ�����ӷ���ʽΪ ���ɴ˿�֪CD��FD2�л�ԭ�Խ�ǿ���� ���ѧʽ����
��4��A��C��D��F����Ԫ�ذ�ԭ�Ӹ�����Ϊ5 ��1 ��4 ��1�γɻ�����ף���Ļ�ѧʽΪ ����0.01mol/L�ļ���Һ��0.03mol/L��Ba(OH)2��Һ�������ϵõ���������֪�ó�����Ksp="x" ��������Һ��������ӵ�Ũ��Ϊ mol / L���ú�x�Ĵ���ʽ��ʾ����Ϻ���Һ����仯���Բ��ƣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
����˵������ȷ���ǣ� ��
| A�������м���Խ����Խ���������Խ�ȶ� |
| B��sp3�ӻ��������ͬһ��ԭ�������������s �����p�����������γɵ�һ������������¹�� |
| C��PCl5������Pԭ�Ӻ�Clԭ������㶼����8���ӽṹ |
| D���ü۲���ӻ�������Ԥ��H2S��BF3������ṹ���ֱ�ΪV�κ�ƽ���������� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com