
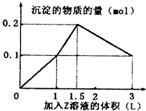
 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )| A. | 偏铝酸钠、氢氧化钡、硫酸 | B. | 偏铝酸钠、氯化钡、硫酸 | ||
| C. | 氯化铝、氯化镁、氢氧化钠 | D. | 氯化铝、氯化铁、氢氧化钠 |
分析 如果Z为氢氧化钠,则发生反应为:Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓,Al(OH)3+OH-=AlO2-+2H2O,溶解0.1mol氢氧化铝沉淀消耗的碱的物质的量为0.15mol,不符合题意,X不能是铝盐,Z不能是氢氧化钠,所以Z是硫酸溶液,根据图象分析解答.
解答 解:A.若X、Y、Z分别为偏铝酸钠、氢氧化钡、硫酸,逐渐加入硫酸时依次发生反应:2OH-+2H++Ba2++SO42-=BaSO4↓2H2O,图中第一段直线:0.1molBa(OH)2和硫酸反应,消耗0.1molH2SO4生成沉淀1mol,氢氧化钡消耗完后,继续滴入硫酸,氢离子开始和偏铝酸根离子反应H++AlO2-+H2O=Al(OH)3↓,硫酸的消耗量和沉淀的生成量是1:2,即0.1molNaAlO2消耗0.05molH2SO4生成沉淀0.1mol;硫酸进一步过量,开始消耗沉淀,Al(OH)3+3H+=Al3++3H2O硫酸和沉淀消耗量应为1.5:1直到把氢氧化铝完全溶解,只剩下不溶于酸的BaSO4,以上三段符合图象的数值变化;故A正确;
B.若X、Y、Z分别为偏铝酸钠、氯化钡、硫酸,滴入硫酸时发生反应:Ba2++SO42-=BaSO4↓,H++AlO2-+H2O=Al(OH)3↓,Al(OH)3+3H+=Al3++3H2O,生成最大量沉淀氢氧化铝0.1mol,需要硫酸0.05mol;生成硫酸钡沉淀0.05mol,需要硫酸0.05mol,图中第一段直线不符合,故B错误;
C.若X、Y、Z分别为氯化铝、氯化镁、氢氧化钠,开始滴入氢氧化钠时,Mg2++2OH-=Mg(OH)2↓,Al3++3OH-=Al(OH)3↓,n(Mg2+):n(OH-)=1:2,n(Al3+):n(OH-)=1:3,继续滴加Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)=1:1,不符合图象的数值变化,故C错误;
D.若X、Y、Z分别为氯化铝、氯化铁、氢氧化钠,开始滴入氢氧化钠时,Al3++3OH-=Al(OH)3↓,Fe3++3OH-=Fe(OH)3↓,n(Al3+):n(OH-)=1:3,n(Fe3+):n(OH-)=1:3,继续滴加Al(OH)3+OH-=AlO2-+2H2O,n(Al(OH)3):n(OH-)=1:1,不符合图象的数值变化,故D错误;
故选:A.
点评 本题考查了铝盐、偏铝酸盐和钡盐的等与碱、酸反应的图象分析判断,题目难度较大,明确物质的性质及离子反应先后关系是解题关键,侧重考查学生分析问题能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{cV}{x}$×100% | B. | $\frac{cV}{25x}$×100% | C. | $\frac{40cV}{x}$×100% | D. | $\frac{cV}{4x}$×100% |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高一上月考二化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.碳酸钙难溶于水,放入水中溶液不导电,且碳酸钙在高温条件下分解,不存在熔融状态下的性质,故碳酸钙是非电解质
B.液态HCl、固体NaCl均不导电,所以液态HCl、固体NaCl均不是电解质
C.SO2溶于水后得到的水溶液导电,所以SO2是电解质
D.H3PO4晶体在熔融状态下不导电,但溶于水后其水溶液导电,故H3PO4是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 除去Cl2中的HCl | 制取少量纯净的CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
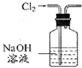 | 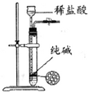 | 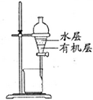 | 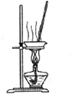 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol0.5mol/L硅酸钠溶液中滴入盐酸所制得的硅酸胶体中,含胶粒数目为0.001NA | |
| B. | 8.4gNaHCO3固体中含有的离子总数为0.3NA | |
| C. | 25℃时,1LpH=1的CH3COOH溶液中含有H+数目为0.1NA | |
| D. | 7.8gCaF2固体中含有的共用电子对数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷是天然气的主要成分,是最简单的烃,其含碳量为75% | |
| B. | 乙醇的分子式为C2H6O,常温下是一种无色液体,密度比水小 | |
| C. | 乙酸的结构简式是CH3COOH,能和水以任意比互溶,酸性比碳酸强 | |
| D. | 乙烯是重要的化工原料,能使溴水和酸性高锰酸钾溶液褪色,具有漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 加碘食盐中加入的是碘单质,可防止甲状腺肿大疾病 | |
| D. | 要除去衣服上的顽固污渍,均可将衣服泡在漂白液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com